

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Untersuchung der Leberfunktion
Untersuchung der Leberfunktion
 Angiographie: ἀγγεῖον = Gefäß, γράφειν zeichnen, beschreiben
Angiographie: ἀγγεῖον = Gefäß, γράφειν zeichnen, beschreiben| Der Zustand der Leber -- lasst sich einerseits an Symptomen ablesen, die sich durch reduzierte Funktionsfähigkeit ergeben (sinkende Plasmaproteinwerte, Gerinnungsstörungen, veränderte Aminosäurespiegel, Ammoniumanstieg, Fettverdauungsstörungen, Gelbsucht, Hypoglykämie, gestörter Elektrolythaushalt bis hin zu Ödemen und hepatorenalem Syndrom); -- andererseits steigt die Konzentration von Enzymen im Blutplasma, die sich in Leberzellen befinden und bei Zellschädigung vermehrt in den Extrazellulärraum abgegeben werden (Transferasen, Dehydrogenasen, alkalische Phosphatase, γ-GT). -- Vergößerung der Leber ist tastbar, bildgebende Verfahren präzisieren den Befund, Gallengänge sind mittels endoskopischer retrograder Cholangiopankreatikografie (ERCP) darstellbar. |

 Abbildung: Zeichen akuten Leberversagens
Abbildung: Zeichen akuten Leberversagens
 Gerinnungsstörungen
Gerinnungsstörungen Gestörter Eiweißstoffwechsel - Aminosäuren:
Gestörter Eiweißstoffwechsel - Aminosäuren:  Aus dem schwindenden Muskelgewebe
werden vermehrt verzweigtkettige Aminosäuren (Valin, Leuzin, Isoleuzin)
für den Energiestoffwechsel gebraucht, der Plasmaspiegel dieser
Aminosäuren sinkt
Aus dem schwindenden Muskelgewebe
werden vermehrt verzweigtkettige Aminosäuren (Valin, Leuzin, Isoleuzin)
für den Energiestoffwechsel gebraucht, der Plasmaspiegel dieser
Aminosäuren sinkt Die Konzentration aromatischer Aminosäuren (Tyrosin,
Phenylalanin) und des Methionins steigen, weil sie nicht im normalen
Ausmaß metabolisiert werden
Die Konzentration aromatischer Aminosäuren (Tyrosin,
Phenylalanin) und des Methionins steigen, weil sie nicht im normalen
Ausmaß metabolisiert werden Gesenkte Produktion von Gallensäuren bedingt Fettverdauungsstörungen
Gesenkte Produktion von Gallensäuren bedingt Fettverdauungsstörungen Ikterus
Ikterus  (Gelbsucht) wegen gestörter Bilirubin-Ausscheidung
(Gelbsucht) wegen gestörter Bilirubin-Ausscheidung Ungenügende Bereitstellung von Zucker bedingt Hypoglykämie
Ungenügende Bereitstellung von Zucker bedingt Hypoglykämie Plasmaeiweiße wie Albumin, Transferrin u.a. zeigen sinkende
Konzentration, im Extremfall können Ödeme (gesenkter kolloidosmotischer
Effekt) auftreten
Plasmaeiweiße wie Albumin, Transferrin u.a. zeigen sinkende
Konzentration, im Extremfall können Ödeme (gesenkter kolloidosmotischer
Effekt) auftreten Stoffwechselstörung im Bereich von Vitaminen und Spurenelementen,
insbesondere der Vitamine B1 und B6, Folsäure, Vit. D, K, Eisen, Kupfer, und Zink
Stoffwechselstörung im Bereich von Vitaminen und Spurenelementen,
insbesondere der Vitamine B1 und B6, Folsäure, Vit. D, K, Eisen, Kupfer, und Zink Gestörter Elektrolythaushalt (Anstieg des Körper-Natriums: Mangelnder
Abbau von Aldosteron), Wasserretention (und Hyponatriämie)
Gestörter Elektrolythaushalt (Anstieg des Körper-Natriums: Mangelnder
Abbau von Aldosteron), Wasserretention (und Hyponatriämie) Bei
schwerem / akutem Leberversagen hepatorenales Syndrom, Hirnödem,
Atemstörungen, Pfortaderhochdruck, Ileus u.a. (
Bei
schwerem / akutem Leberversagen hepatorenales Syndrom, Hirnödem,
Atemstörungen, Pfortaderhochdruck, Ileus u.a. ( Abbildung)
Abbildung) Anamnese und klinisches Zustandsbild (Ödeme? Ikterus? etc)
Anamnese und klinisches Zustandsbild (Ödeme? Ikterus? etc)  Leberzellintegrität:
Beschädigte Hepatozyten verlieren Enzyme an den Extrazellulärraum, in
dem sie normalerweise nur in geringer Konzentration (bedingt durch
physiologischen Molekülverlust und kontinuierlichen Zelluntergang)
auftauchen - wie
Leberzellintegrität:
Beschädigte Hepatozyten verlieren Enzyme an den Extrazellulärraum, in
dem sie normalerweise nur in geringer Konzentration (bedingt durch
physiologischen Molekülverlust und kontinuierlichen Zelluntergang)
auftauchen - wie  Aspartat-Aminotransferase - ASAT, AST, vormals (Serum-) Glutamat-Oxalacetat-Transaminase GOT,
Aspartat-Aminotransferase - ASAT, AST, vormals (Serum-) Glutamat-Oxalacetat-Transaminase GOT,  Alanin-Aminotransferase -ALAT, ALT, vormals (Serum-) Glutamat-Pyruvat-Transaminase GPT,
Alanin-Aminotransferase -ALAT, ALT, vormals (Serum-) Glutamat-Pyruvat-Transaminase GPT,  Alkalische Phosphatase (AP),
Alkalische Phosphatase (AP),  gamma-Glutamyltransferase (γ-GT),
gamma-Glutamyltransferase (γ-GT), Glutamat-Dehydrogenase (GLDH),
Glutamat-Dehydrogenase (GLDH),  Lactat-Dehydrogenase (LDH)
Lactat-Dehydrogenase (LDH) 
 Abbildung: Enzyme wie AST und ALT werden bei Zellschädigung ins Blut abgegeben
Abbildung: Enzyme wie AST und ALT werden bei Zellschädigung ins Blut abgegeben ALT, Alanin-Aminotransferase, Leberindikator
ALT, Alanin-Aminotransferase, Leberindikator
 ALT befindet sich vorwiegend im Zytoplasma
der Hepatozyten. Mäßige Schwankungen des ALT-Spiegels im Tagesverlauf
sind physiologisch, nach körperlicher Belastung nimmt er zu, ebenso
schon bei relativ leichter Schädigung von Leberzellen.
ALT befindet sich vorwiegend im Zytoplasma
der Hepatozyten. Mäßige Schwankungen des ALT-Spiegels im Tagesverlauf
sind physiologisch, nach körperlicher Belastung nimmt er zu, ebenso
schon bei relativ leichter Schädigung von Leberzellen. AST befindet sich in Leberzellen überwiegend in den Mitochondrien (Isoform mAST). Anstieg der AST-Konzentration im Blutplasma deutet auf deutliche Zellschädigung hin.
AST befindet sich in Leberzellen überwiegend in den Mitochondrien (Isoform mAST). Anstieg der AST-Konzentration im Blutplasma deutet auf deutliche Zellschädigung hin. (AST/ALT ratio, De Ritis ratio)
bezeichnet. Da ALT leichter aus der Zelle entweicht als AST und im Blut
eine höhere biologische Halbwertszeit aufweist, liegt der Betrag des De
Ritis-Quotienten normalerweise unter 1,0. Bei Entzündungen kann der
Quotient sogar auf ~0,5 absinken; erst bei schweren Schäden an den Hepatozyten steigt er über 1 an (AST ist vor allem an Mitochondrien fixiert).
(AST/ALT ratio, De Ritis ratio)
bezeichnet. Da ALT leichter aus der Zelle entweicht als AST und im Blut
eine höhere biologische Halbwertszeit aufweist, liegt der Betrag des De
Ritis-Quotienten normalerweise unter 1,0. Bei Entzündungen kann der
Quotient sogar auf ~0,5 absinken; erst bei schweren Schäden an den Hepatozyten steigt er über 1 an (AST ist vor allem an Mitochondrien fixiert). GLDH ist ausschließlich in den Mitochondrien
lokalisiert (und fast nur in Leberzellen), bei schwerer Zellschädigung
(nekrotischer Leberschaden) steigt auch der GLDH-Spiegel im Blutplasma
an.
GLDH ist ausschließlich in den Mitochondrien
lokalisiert (und fast nur in Leberzellen), bei schwerer Zellschädigung
(nekrotischer Leberschaden) steigt auch der GLDH-Spiegel im Blutplasma
an. Serumcholinesterase (Serum, Plasma)
Serumcholinesterase (Serum, Plasma) Bilirubin: Das aus dem Abbau von Hämoglobin (~80%) und anderen Hämgruppen stammende Bilirubin
ist wasserunlöslich und bindet im Blutserum reversibel an Albumin,
wodurch es transportfähig wird. Normalerweise liegt Bilirubin im Blut zum Großteil in unkonjugierter ("indirekter") Form vor, also an Plasmaprotein gebunden.
Bilirubin: Das aus dem Abbau von Hämoglobin (~80%) und anderen Hämgruppen stammende Bilirubin
ist wasserunlöslich und bindet im Blutserum reversibel an Albumin,
wodurch es transportfähig wird. Normalerweise liegt Bilirubin im Blut zum Großteil in unkonjugierter ("indirekter") Form vor, also an Plasmaprotein gebunden.  Liegt bei einem Ikterus der Anteil an direktem (konjugiertem) Serum-Bilirubin unter 20%, kann auf eine prähepatische Störung geschlossen werden ("Produktionsikterus", z.B. durch erhöhte Hämolyse). Das Überangebot kann von der Leber nicht ausreichend bearbeitet (mit
Glukuronsäure konjugiert und damit wasserlöslich gemacht) werden, unkonjugiertes (an Albumin gebundenes, "indirektes") Bilirubin dominiert.
Liegt bei einem Ikterus der Anteil an direktem (konjugiertem) Serum-Bilirubin unter 20%, kann auf eine prähepatische Störung geschlossen werden ("Produktionsikterus", z.B. durch erhöhte Hämolyse). Das Überangebot kann von der Leber nicht ausreichend bearbeitet (mit
Glukuronsäure konjugiert und damit wasserlöslich gemacht) werden, unkonjugiertes (an Albumin gebundenes, "indirektes") Bilirubin dominiert. Hepatische Hyperbilirubinämie kann folgende Gründe haben: Gestörte Bilirubinaufnahme der Leberzellen ("Absorptionsikterus"), gestörte Konjugationsleistung ("Konjugationsikterus") oder Exkretion in die Gallencanaliculi ("Exkretionsikterus"). Dabei kann konjugiertes oder unkonjugiertes Bilirubin akkumulieren, je nach Mikrolokalisation der Störung in den Hepatozyten.
Hepatische Hyperbilirubinämie kann folgende Gründe haben: Gestörte Bilirubinaufnahme der Leberzellen ("Absorptionsikterus"), gestörte Konjugationsleistung ("Konjugationsikterus") oder Exkretion in die Gallencanaliculi ("Exkretionsikterus"). Dabei kann konjugiertes oder unkonjugiertes Bilirubin akkumulieren, je nach Mikrolokalisation der Störung in den Hepatozyten. Verschluss der Gallenwege (extrahepatisch), z.B. durch einen Gallenstein, führt zu posthepatischer Hyperbilirubimämie ("Kanalisationsikterus"). Hier akkumuliert konjugiertes ("direktes") Bilirubin im Blut, sein Anteil am Gesamtbilirubin im Serum steigt auf über 50%.
Verschluss der Gallenwege (extrahepatisch), z.B. durch einen Gallenstein, führt zu posthepatischer Hyperbilirubimämie ("Kanalisationsikterus"). Hier akkumuliert konjugiertes ("direktes") Bilirubin im Blut, sein Anteil am Gesamtbilirubin im Serum steigt auf über 50%. Der Ammoniumspiegel kann bei Leberdefekten
(z.B. Zirrhose) ansteigen, weil die normale Umwandlung zu Harnstoff
unzureichend funktioniert (Hyperammonämie)
Der Ammoniumspiegel kann bei Leberdefekten
(z.B. Zirrhose) ansteigen, weil die normale Umwandlung zu Harnstoff
unzureichend funktioniert (Hyperammonämie) Bei gestörter biliärer Exkretion (posthepatisch) steigt vor allem der Spiegel des konjugierten ("direkten") Bilirubins an; Ikterus (Gelbsucht) kann auftreten
Bei gestörter biliärer Exkretion (posthepatisch) steigt vor allem der Spiegel des konjugierten ("direkten") Bilirubins an; Ikterus (Gelbsucht) kann auftreten Alkalische
Phosphatasen (AP) sind Esterasen und befinden sich im Skelettsystem (Knochen), Leberparenchym und in den
Gallengangsepithelien. Cholestase (Gallenstau) bewirkt, dass
Gallensäuren vermehrt alkalische Phosphatase aus der Hepatozytenmembran
lösen
Alkalische
Phosphatasen (AP) sind Esterasen und befinden sich im Skelettsystem (Knochen), Leberparenchym und in den
Gallengangsepithelien. Cholestase (Gallenstau) bewirkt, dass
Gallensäuren vermehrt alkalische Phosphatase aus der Hepatozytenmembran
lösen γ-Glutamyl-Transpeptidase
(γ-GT) findet
sich (außer in den Nieren) vor allem in den Gallengängen, so macht sich auch hier der
Einfluss der Gallensäuren bei Cholestase bemerkbar. (Die γ-GT-Aktivität
in der Niere ist höher, aber das Enzym wird renal nicht ins Blut,
sondern in den Harn freigesetzt.)
γ-Glutamyl-Transpeptidase
(γ-GT) findet
sich (außer in den Nieren) vor allem in den Gallengängen, so macht sich auch hier der
Einfluss der Gallensäuren bei Cholestase bemerkbar. (Die γ-GT-Aktivität
in der Niere ist höher, aber das Enzym wird renal nicht ins Blut,
sondern in den Harn freigesetzt.)

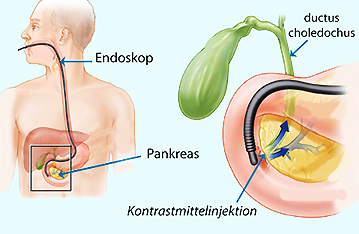
 Abbildung: Schema der Durchführung eines ERCP
Abbildung: Schema der Durchführung eines ERCP Sonographie (Ultraschall-Bildgebung)
Sonographie (Ultraschall-Bildgebung) 
 Angiographie (Darstellung von Blutgefäßen)
Angiographie (Darstellung von Blutgefäßen) 
 Magnetresonanz-Imaging (Kernspinresonanz-Prinzip)
Magnetresonanz-Imaging (Kernspinresonanz-Prinzip) Szintigraphie (Verteilung eines radioaktiven Markers im Organ)
Szintigraphie (Verteilung eines radioaktiven Markers im Organ) 
 Endoskopische retrograde
Cholangiopankreatikographie (ERCP
-
Endoskopische retrograde
Cholangiopankreatikographie (ERCP
-  Abbildung; Kontrastmittel wird zwischen Gallen- und Pankreasgang
ins Duodenum injiziert, diese stellen sich daraufhin im Röntgenbild dar).
Abbildung; Kontrastmittel wird zwischen Gallen- und Pankreasgang
ins Duodenum injiziert, diese stellen sich daraufhin im Röntgenbild dar).

 Zur Beurteilung der Leberfunktion gehören Enzymwerte im Blut (steigen bei Beschädigung der Hepatozyten): Aspartat-Aminotransferase
(AST), Alanin-Aminotransferase (ALT), Alkalische Phosphatase (AP),
Glutamat-Dehydrogenase (GLDH), Lactat-Dehydrogenase (LDH); besonders empfindlich (mäßig spezifisch) reagiert γ-Glutamyltransferase (γ-GT), insbesondere auf Probleme im Gallengangsystem Zur Beurteilung der Leberfunktion gehören Enzymwerte im Blut (steigen bei Beschädigung der Hepatozyten): Aspartat-Aminotransferase
(AST), Alanin-Aminotransferase (ALT), Alkalische Phosphatase (AP),
Glutamat-Dehydrogenase (GLDH), Lactat-Dehydrogenase (LDH); besonders empfindlich (mäßig spezifisch) reagiert γ-Glutamyltransferase (γ-GT), insbesondere auf Probleme im Gallengangsystem  Die Synthesekapazität beschädigter Leberzellen ist eingeschränkt. Zu
den Symptomen einer Insuffizienz gehören Gerinnungsstörungen,
veränderte Aminosäuremuster im Blut, Fettverdauungsstörungen (mangelnde Emulgierung wegen Mangel an Gallensäuren),
Ikterus (Bilirubinerhöhung), Hypoglykämie, Hypoproteinämie, gestörter Elektrolyt-,
Spurenelement- und Vitaminhaushalt; bei schwerem Leberversagen
Pfortaderhochdruck, hepatorenales Syndrom, Hirnödem, Atemstörungen Die Synthesekapazität beschädigter Leberzellen ist eingeschränkt. Zu
den Symptomen einer Insuffizienz gehören Gerinnungsstörungen,
veränderte Aminosäuremuster im Blut, Fettverdauungsstörungen (mangelnde Emulgierung wegen Mangel an Gallensäuren),
Ikterus (Bilirubinerhöhung), Hypoglykämie, Hypoproteinämie, gestörter Elektrolyt-,
Spurenelement- und Vitaminhaushalt; bei schwerem Leberversagen
Pfortaderhochdruck, hepatorenales Syndrom, Hirnödem, Atemstörungen  Bei
stark gesteigerter Hämolyse erhöht sich albumingebundenes (indirektes,
nichtkonjugiertes) Bilirubin (konjugiertes Bilirubin <20%, prähepatischer oder "Produktionsikterus"). Bei hepatischen Blockaden kann die Bilirubinaufnahme ("Absorptionsikterus"),
Konjugationsleistung ("Konjugationsikterus") oder die Ausscheidung in
die Gallengänge gestört sein ("Exkretionsikterus"). Dabei kann
sowohl konjugiertes als auch unkonjugiertes Bilirubin akkumulieren, je nach
Mikrolokalisation der Störung. Posthepatische
Hyperbilirubinämie entsteht durch Behinderung des Gallenabflusses, z.B.
durch einen Gallenstein - dabei steigt der Anteil des konjugierten
(direkten) Bilirubins im Blut auf >50% Bei
stark gesteigerter Hämolyse erhöht sich albumingebundenes (indirektes,
nichtkonjugiertes) Bilirubin (konjugiertes Bilirubin <20%, prähepatischer oder "Produktionsikterus"). Bei hepatischen Blockaden kann die Bilirubinaufnahme ("Absorptionsikterus"),
Konjugationsleistung ("Konjugationsikterus") oder die Ausscheidung in
die Gallengänge gestört sein ("Exkretionsikterus"). Dabei kann
sowohl konjugiertes als auch unkonjugiertes Bilirubin akkumulieren, je nach
Mikrolokalisation der Störung. Posthepatische
Hyperbilirubinämie entsteht durch Behinderung des Gallenabflusses, z.B.
durch einen Gallenstein - dabei steigt der Anteil des konjugierten
(direkten) Bilirubins im Blut auf >50%  Leberdefekte mit eingeschränkter Harnstoffsynthese erhöhen den Ammoniumspiegel (Hyperammonämie) Leberdefekte mit eingeschränkter Harnstoffsynthese erhöhen den Ammoniumspiegel (Hyperammonämie)  Bildgebende
Verfahren für hepatologische Untersuchungen sind Sonografie
(Ultraschall), Angiografie, Magnetresonanz, Szintigrafie (Verteilung
eines radioaktiven Markers), endoskopische retrograde
Cholangiopancreaticografie (ERCP - Kontrastmitteldarstellung von
Gallen- und Pankreasgang) Bildgebende
Verfahren für hepatologische Untersuchungen sind Sonografie
(Ultraschall), Angiografie, Magnetresonanz, Szintigrafie (Verteilung
eines radioaktiven Markers), endoskopische retrograde
Cholangiopancreaticografie (ERCP - Kontrastmitteldarstellung von
Gallen- und Pankreasgang) |
