



 Agouti-related: Der für die Fellfarbe "agouti" verantwortliche Genlokus ist nach einem Nagetier benannt
Agouti-related: Der für die Fellfarbe "agouti" verantwortliche Genlokus ist nach einem Nagetier benannt| Organe und Gewebe interagieren über endokrine und neuronale Signale. Einige Beispiele: -- Darm, Leber, Nieren, Milz und Knochenmark arbeiten bei der Regulierung von Eisenhomöostase, Erythropoese und Sauerstofftransport zusammen -- Die Steuerung der Nahrungsaufnahme stimmt Substrat- und Energiestoffwechsel aufeinander ab: "Hungerzentrum" im lateralen Hypothalamus, "Sattheitszentrum" im medialen Hypothalamus, nucleus tractus solitarii im Hirnstamm, Signalstoffe aus dem gastrointestinalen System -- Die Leber als zentrales Stoffwechselorgan, die Nieren als Aufbereitungsorgan der Körperflüssigkeiten und das Gehirn als Konsument und gleichzeitig Steuerzentrale haben verknüpfte Funktionen -- Muskel- und Fettgewebe produzieren Myokine und Adipokine, mit denen sie aufeinander einwirken, in der Leber Stoffwechselschritte induzieren und den Hypothalamus beeinflussen -- Im Säure-Basen-Haushalt kooperieren Atmung (Abgabe von Kohlensäure), Nieren- (metabolische Regulation, Harn-pH) und Leberfunktion (Glutaminmechanismus, Stickstoffausscheidung). |

 Abbildung: Zusammenspiel von Organen bei der Regulierung des Sauerstofftransports
Abbildung: Zusammenspiel von Organen bei der Regulierung des Sauerstofftransports
 Abbildung).
Abbildung).
 Abbildung: Interaktion zwischen Wachstumshormonen, freien Fettsäuren und Insulin - Wirkung auf Leber, Fett- und Muskelgewebe
Abbildung: Interaktion zwischen Wachstumshormonen, freien Fettsäuren und Insulin - Wirkung auf Leber, Fett- und Muskelgewebe TBF, total body fat
TBF, total body fat  VAT, viszerales Fettgewebe
VAT, viszerales Fettgewebe  VLDL, very-low density lipoprotein
VLDL, very-low density lipoprotein
 Abbildung). Therapeutische Verabreichung
von GH hat bei übergewichtigen Patienten vorteilhafte Wirkungen
(Abnahme des Fettgewebes, besonders viszerales Fett), doch zeigen
klinische Studien teils widersprüchliche Gesamteffekte.
Abbildung). Therapeutische Verabreichung
von GH hat bei übergewichtigen Patienten vorteilhafte Wirkungen
(Abnahme des Fettgewebes, besonders viszerales Fett), doch zeigen
klinische Studien teils widersprüchliche Gesamteffekte. Viele Organfunktionen sind neuronal und biochemisch miteinander verknüpft, insbesondere das Substrat- und
Metabolitenangebot über den Kreislauf hat Auswirkungen auf praktisch
alle Gewebe und Organe des Körpers. Leber (als zentrales
Stoffwechselorgan), Nieren (als "Aufbereitungsanlage" für die
Körperflüssigkeiten) und Gehirn
(als Konsument und oberstes
Steuerorgan) sind Organe, die auf regen Stoffaustausch untereinander,
aber auch mit anderen Geweben angewiesen sind. Bei Fehlfunktion der
Leber kann es zu einer hepatischen Enzephalopathie oder Nierenversagen
kommen.
Viele Organfunktionen sind neuronal und biochemisch miteinander verknüpft, insbesondere das Substrat- und
Metabolitenangebot über den Kreislauf hat Auswirkungen auf praktisch
alle Gewebe und Organe des Körpers. Leber (als zentrales
Stoffwechselorgan), Nieren (als "Aufbereitungsanlage" für die
Körperflüssigkeiten) und Gehirn
(als Konsument und oberstes
Steuerorgan) sind Organe, die auf regen Stoffaustausch untereinander,
aber auch mit anderen Geweben angewiesen sind. Bei Fehlfunktion der
Leber kann es zu einer hepatischen Enzephalopathie oder Nierenversagen
kommen.
 Abbildung: Wechselwirkungen zwischen Nieren-, Leber- und respiratorischer Funktion bei der Einstellung des pH-Wertes
Abbildung: Wechselwirkungen zwischen Nieren-, Leber- und respiratorischer Funktion bei der Einstellung des pH-Wertes 
 Über die Interaktion von Gehirn, Muskeln und Fettgewebe bei der regulierten zitterfreien Thermogenese s. dort
Über die Interaktion von Gehirn, Muskeln und Fettgewebe bei der regulierten zitterfreien Thermogenese s. dort Der Blutspiegel des Adipokins Leptin
Der Blutspiegel des Adipokins Leptin  korreliert mit der Masse des Fettgewebes im Körper. Es wirkt über Leptinrezeptoren (LEP-R), die zur Familie der Zytokinrezeptoren
gehören. Leptin wird fast ausschließlich von Adipozyten gebildet und
sagt dem Gehirn, wie viel Fett im Körper gespeichert ist (es kann die
Blut-Hirn-Schranke überwinden). Leptin wirkt anorexigen (es bewirkt
Sattheitsempfinden); Leptinmangel löst Hyperphagie aus.
korreliert mit der Masse des Fettgewebes im Körper. Es wirkt über Leptinrezeptoren (LEP-R), die zur Familie der Zytokinrezeptoren
gehören. Leptin wird fast ausschließlich von Adipozyten gebildet und
sagt dem Gehirn, wie viel Fett im Körper gespeichert ist (es kann die
Blut-Hirn-Schranke überwinden). Leptin wirkt anorexigen (es bewirkt
Sattheitsempfinden); Leptinmangel löst Hyperphagie aus. Abbildung).
Abbildung).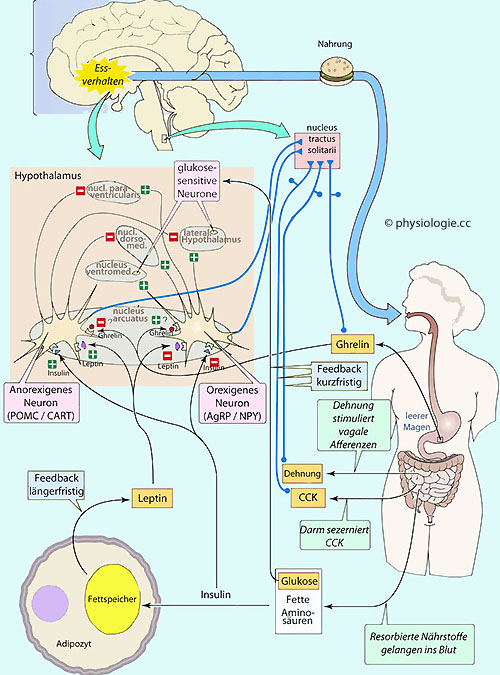
 Abbildung: Appetit-Kontrollsystem - orexigene und anorexigene Faktoren
Abbildung: Appetit-Kontrollsystem - orexigene und anorexigene Faktoren CART, cocaine and amphetamine related transcript
CART, cocaine and amphetamine related transcript  CCK, Cholezystokinin
CCK, Cholezystokinin  NPY, Neuropeptid Y
NPY, Neuropeptid Y  POMC, Proopiomelanocortin
POMC, Proopiomelanocortin vgl. dort
vgl. dort 
 Im Hypothalamus
hemmt Stimulation von Leptinrezeptoren das
Hungergefühl, indem die Effekte von NPY und Anandamid antagonisiert,
und die Bildung von α-MSH gefördert werden.
Dies ist ein Langzeiteffekt.
Im Hypothalamus
hemmt Stimulation von Leptinrezeptoren das
Hungergefühl, indem die Effekte von NPY und Anandamid antagonisiert,
und die Bildung von α-MSH gefördert werden.
Dies ist ein Langzeiteffekt.  Peripher
finden sich Leptinrezeptoren an zahlreichen Zelltypen. Sie spielen eine
große Rolle für den Energiehaushalt, auch für den Kreislauf, das
Reproduktionssystem (Fertilität, Zyklus, Schwangerschaft, Laktation),
das Bewegungssystem, Immunsystem usw.
Peripher
finden sich Leptinrezeptoren an zahlreichen Zelltypen. Sie spielen eine
große Rolle für den Energiehaushalt, auch für den Kreislauf, das
Reproduktionssystem (Fertilität, Zyklus, Schwangerschaft, Laktation),
das Bewegungssystem, Immunsystem usw.
 Resistin,
auch adipose tissue-specific secretory factor (ADSF) genannt, ist ein Adipokin, das auch von Immunzellen und Epithelien sezerniert wird. Seine physiologische Rolle beim
Menschen (Übergewicht? Diabetes?) ist noch umstritten.
Resistin,
auch adipose tissue-specific secretory factor (ADSF) genannt, ist ein Adipokin, das auch von Immunzellen und Epithelien sezerniert wird. Seine physiologische Rolle beim
Menschen (Übergewicht? Diabetes?) ist noch umstritten. Adiponektin stammt auch aus der Plazenta und wird umgekehrt proportional zur Masse des Fettgewebes freigesetzt. Der (mit 2-20 mg/l für ein Proteohormon hohe) Adiponektinspiegel steigt bei Kalorienrestriktion; bei Übergewichtigen ist er am niedrigsten. Frauen weisen höhere Adiponektinspiegel auf als Männer (Sexualdimorphismus).
Adiponektin reguliert mit anderen Adipokinen sowie Insulin den
Energiestoffwechasel (Hungergefühl, Nahrungsaufnahme, Zuckerhaushalt,
Fettsäureoxidation).
Adiponektin stammt auch aus der Plazenta und wird umgekehrt proportional zur Masse des Fettgewebes freigesetzt. Der (mit 2-20 mg/l für ein Proteohormon hohe) Adiponektinspiegel steigt bei Kalorienrestriktion; bei Übergewichtigen ist er am niedrigsten. Frauen weisen höhere Adiponektinspiegel auf als Männer (Sexualdimorphismus).
Adiponektin reguliert mit anderen Adipokinen sowie Insulin den
Energiestoffwechasel (Hungergefühl, Nahrungsaufnahme, Zuckerhaushalt,
Fettsäureoxidation). Visfatin,
ein weiteres Proteohormon, das aus viszeralem Fettgewebe stammt und
dessen Plasmaspiegel mit dem Grad einer Adipositas korreliert. Es
steigert die Insulinempfindlichkeit und senkt den Blutzuckerspiegel.
Visfatin,
ein weiteres Proteohormon, das aus viszeralem Fettgewebe stammt und
dessen Plasmaspiegel mit dem Grad einer Adipositas korreliert. Es
steigert die Insulinempfindlichkeit und senkt den Blutzuckerspiegel. Abbildung:
Wirkung von Kortisol, Katecholaminen, Wachstumshormon und
Schilddrüsenhormonen auf Substratflüsse zwischen Organen und Geweben
Abbildung:
Wirkung von Kortisol, Katecholaminen, Wachstumshormon und
Schilddrüsenhormonen auf Substratflüsse zwischen Organen und Geweben Glc, Glucose
Glc, Glucose  Glg, Glykogen
Glg, Glykogen  Fs, Fettsäuren
Fs, Fettsäuren  KK, Ketonkörper
KK, Ketonkörper  Pr, Protein
Pr, Protein  Tg, Triglyzeride
Tg, Triglyzeride
 Über Substratflüsse zwischen Organen und Geweben und ihre hormonelle Beeinflussung s. u.a. dort und
Über Substratflüsse zwischen Organen und Geweben und ihre hormonelle Beeinflussung s. u.a. dort und  Abbildung.
Abbildung.

 Abbildung:
Das Renin- Angiotensin- Aldosteronsystem und die Salz-Wasser-Bilanz des
Körpers sind mit der Kreislauffunktion rückgekoppelt
Abbildung:
Das Renin- Angiotensin- Aldosteronsystem und die Salz-Wasser-Bilanz des
Körpers sind mit der Kreislauffunktion rückgekoppelt
 Verminderte
Dehnung kardiopulmonaler Rezeptoren führt zu reflektorischer
Aktivierung des Renin- Angiotensin- Aldosteron- Systems in der Niere und der Aktivierung des Sympathikus sowie der Bildung von Adiuretin (=Vasopressin) im Gehirn.
Verminderte
Dehnung kardiopulmonaler Rezeptoren führt zu reflektorischer
Aktivierung des Renin- Angiotensin- Aldosteron- Systems in der Niere und der Aktivierung des Sympathikus sowie der Bildung von Adiuretin (=Vasopressin) im Gehirn.  Das Herz wirkt andererseits über atriale natriuretische Peptide und baroreflektorisch auf die Nierenfunktion ein, beeinflusst dort u.a. die Ausscheidung von Salz und Wasser. In all diesen Fällen ist die Regulation der Funktionen des Kreislaufs eine zentrale Drehscheibe der Interaktion der Organe (kardiovaskuläre Reflexe).
Das Herz wirkt andererseits über atriale natriuretische Peptide und baroreflektorisch auf die Nierenfunktion ein, beeinflusst dort u.a. die Ausscheidung von Salz und Wasser. In all diesen Fällen ist die Regulation der Funktionen des Kreislaufs eine zentrale Drehscheibe der Interaktion der Organe (kardiovaskuläre Reflexe). 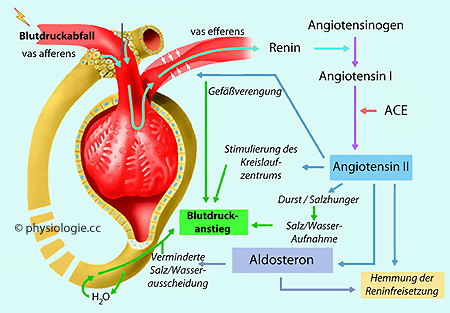
 Abbildung: Blutdruckreduktion aktiviert den Renin- Angiotensin- Aldosteron- Mechanismus
Abbildung: Blutdruckreduktion aktiviert den Renin- Angiotensin- Aldosteron- Mechanismus
 Mechanische Faktoren - Muskelkraft überträgt sich auf Knochengewebe, Knochen geben der Muskelaktion Sinn und Richtung
Mechanische Faktoren - Muskelkraft überträgt sich auf Knochengewebe, Knochen geben der Muskelaktion Sinn und Richtung Parakrine / endokrine Faktoren: Myokine wirken nicht nur auf Muskel-, sondern auch Knochen- und andere Zellen
Parakrine / endokrine Faktoren: Myokine wirken nicht nur auf Muskel-, sondern auch Knochen- und andere Zellen Abbildung) - täglich etwa 20-30 g. Im Blutkreislauf
hat Harnstoff eine biologische Halbwertszeit von nur wenigen Minuten.
Abbildung) - täglich etwa 20-30 g. Im Blutkreislauf
hat Harnstoff eine biologische Halbwertszeit von nur wenigen Minuten.
 Abbildung: NH3-Austausch zwischen Organen
Abbildung: NH3-Austausch zwischen Organen
 Ammonium wird beim Gesunden zu ~50% im Skelettmuskel durch Aktivität der Glutamat-Ammonium-Ligase (früher Glutaminsynthetase) metabolisiert. Nimmt die Fähigkeit der Leber
zur Metabolisierung von Ammoniak zu Glutamat ab, kann das Muskelgewebe zumindest zum
Teil einspringen.
Ammonium wird beim Gesunden zu ~50% im Skelettmuskel durch Aktivität der Glutamat-Ammonium-Ligase (früher Glutaminsynthetase) metabolisiert. Nimmt die Fähigkeit der Leber
zur Metabolisierung von Ammoniak zu Glutamat ab, kann das Muskelgewebe zumindest zum
Teil einspringen.  ) führen zu toxischen Auswirkungen auf das Gehirn (hepatische Enzephalopathie:
verminderte Hirnleistung bis Koma).
) führen zu toxischen Auswirkungen auf das Gehirn (hepatische Enzephalopathie:
verminderte Hirnleistung bis Koma).  Der Glutamin-Glutamat-Mechanismus hilft bei der Säureausscheidung und
setzt die Kooperation von Leber- und Tubuluszellen voraus. Die Leber
stellt aus dem Eiweißabbau die Aminosäure Glutamin zur Verfügung, das
in der Niere zu Glutamat und Ammonium abgebaut wird; letzteres kann ein
Proton aufnehmen und damit Säurevalenzen (als Ammoniumsalz) aus dem
Körper entfernen (
Der Glutamin-Glutamat-Mechanismus hilft bei der Säureausscheidung und
setzt die Kooperation von Leber- und Tubuluszellen voraus. Die Leber
stellt aus dem Eiweißabbau die Aminosäure Glutamin zur Verfügung, das
in der Niere zu Glutamat und Ammonium abgebaut wird; letzteres kann ein
Proton aufnehmen und damit Säurevalenzen (als Ammoniumsalz) aus dem
Körper entfernen ( Abbildung).
Abbildung).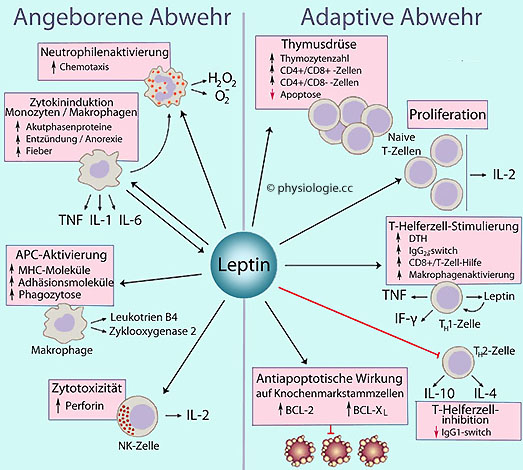
 Abbildung: Wirkungen von Leptin auf das Immunsystem
Abbildung: Wirkungen von Leptin auf das Immunsystem Chemotaxis
Chemotaxis  DTH, delayed type hypersensitivity
DTH, delayed type hypersensitivity  IgG-switch s. isotype switching
IgG-switch s. isotype switching  Interleukine
Interleukine  MHC, main histocompatibility complex
MHC, main histocompatibility complex  Perforin
Perforin  TNF, Tumornekrosefaktor
TNF, Tumornekrosefaktor  Thymus
Thymus 
 Abbildung).
Abbildung).  u.a., Leptin sowie Insulin werden je nach Stoffwechsellage
freigesetzt und beeinflussen die Zentren im ZNS.
u.a., Leptin sowie Insulin werden je nach Stoffwechsellage
freigesetzt und beeinflussen die Zentren im ZNS.  Als orexigen
Als orexigen  gelten Neuropeptid Y (NPY) und das agouti-related peptide (AgRP).
gelten Neuropeptid Y (NPY) und das agouti-related peptide (AgRP).  AgRP / NPY-Nervenzellen werden durch Ghrelin angeregt, durch Leptin, Insulin, CCK gehemmt.
AgRP / NPY-Nervenzellen werden durch Ghrelin angeregt, durch Leptin, Insulin, CCK gehemmt. Anorexigen
Anorexigen  wirken Pro-opio-melanocortin (POMC) und das cocaine and amphetamine related transcript (CART). POMC / Cart-Nervenzellen werden durch Leptin, Insulin und CCK angeregt.
wirken Pro-opio-melanocortin (POMC) und das cocaine and amphetamine related transcript (CART). POMC / Cart-Nervenzellen werden durch Leptin, Insulin und CCK angeregt.
 Abbildung: Gemeinsame Glucoseregulation kooperierender Organe
Abbildung: Gemeinsame Glucoseregulation kooperierender Organe
 Kaliummangel
entsteht durch verstärkte Verluste über die Nieren (harntreibende
Mittel, verstärkte Aldosteronwirkung), Erbrechen oder Durchfall
(Gastrointestinalsystem); Folgen sind vor allem Muskelschwäche und
Herzrhythmusstörungen.
Kaliummangel
entsteht durch verstärkte Verluste über die Nieren (harntreibende
Mittel, verstärkte Aldosteronwirkung), Erbrechen oder Durchfall
(Gastrointestinalsystem); Folgen sind vor allem Muskelschwäche und
Herzrhythmusstörungen.  Hyperkaliämie: Steigt der
Plasma-Kaliumspiegel plötzlich an (z.B. infolge Crush-Syndrom), kommt
es zunächst zu Kaliumaufnahme in die Zellen (Kalium-Puffer,
Normalisierung des Plasmaspiegels); innerhalb von Stunden steigt die
(hormonabhängige) Kaliumsekretion in der Niere.
Hyperkaliämie: Steigt der
Plasma-Kaliumspiegel plötzlich an (z.B. infolge Crush-Syndrom), kommt
es zunächst zu Kaliumaufnahme in die Zellen (Kalium-Puffer,
Normalisierung des Plasmaspiegels); innerhalb von Stunden steigt die
(hormonabhängige) Kaliumsekretion in der Niere.  Zur Physiologie des Natriums (Leitkation der extrazellulären
Flüssigkeit: ~ 15 l bei ~70 kg KG) und
Zur Physiologie des Natriums (Leitkation der extrazellulären
Flüssigkeit: ~ 15 l bei ~70 kg KG) und  Zur Physiologie des
Kaliums (Leitkation der
intrazellulären Flüssigkeit: ~ 30 l bei ~70 kg KG) s. u.a. II.9 und X.6
Zur Physiologie des
Kaliums (Leitkation der
intrazellulären Flüssigkeit: ~ 30 l bei ~70 kg KG) s. u.a. II.9 und X.6  Darm, Leber, Nieren, Milz und Knochenmark kooperieren bei der
Regulierung von Eisenhomöostase und Erythropoese. Das Bindeglied ist
der Sauerstofftransport
Darm, Leber, Nieren, Milz und Knochenmark kooperieren bei der
Regulierung von Eisenhomöostase und Erythropoese. Das Bindeglied ist
der Sauerstofftransport Aufnahme, Verwertung, Speicherung und Abbau energiereicher Biomoleküle
werden über die Steuerung von Hunger und Sattheit koordiniert
("Hungerzentrum" im lateralen Hypothalamus, "Sattheitszentrum" im
medialen Hypothalamus). Rückkopplungsmechanismen ergeben sich durch
Meldungen aus der Peripherie des Körpers (Magen-Darm-Trakt, Pankreas,
Leber, Fettgewebe. Muskulatur)
Aufnahme, Verwertung, Speicherung und Abbau energiereicher Biomoleküle
werden über die Steuerung von Hunger und Sattheit koordiniert
("Hungerzentrum" im lateralen Hypothalamus, "Sattheitszentrum" im
medialen Hypothalamus). Rückkopplungsmechanismen ergeben sich durch
Meldungen aus der Peripherie des Körpers (Magen-Darm-Trakt, Pankreas,
Leber, Fettgewebe. Muskulatur) Gehirn, Atmung, Leber und Nieren arbeiten bei der Stabilisierung des pH-Wertes zusammen: Die Atmung entfernt CO2
aus dem Körper, die Nieren nichtflüchtige Säuren, die Leber wandelt
Ammonium - unter Verbrauch von Bicarbonat - in Harnstoff um, das Gehirn
überwacht die Blutgaswerte Gehirn, Atmung, Leber und Nieren arbeiten bei der Stabilisierung des pH-Wertes zusammen: Die Atmung entfernt CO2
aus dem Körper, die Nieren nichtflüchtige Säuren, die Leber wandelt
Ammonium - unter Verbrauch von Bicarbonat - in Harnstoff um, das Gehirn
überwacht die Blutgaswerte Bei hohem Angebot an Energieträgern sezerniert Fettgewebe Leptin,
dieses hemmt orexigene und fördert anorexigene Mechanismen im
Hypothalamus und wirkt dadurch mehrfach
appetitzügelnd. Bei mangelnder Energieverfügbarkeit sinkt die
Leptinbildung, das befeuert den Hunger. Leptin wirkt auch im
Immunsystem. Die Synthese von Visfatin korreliert mit dem Grad einer
Adipositas. Umgekehrt nimmt die Bildung von Adiponektin mit der Masse
an Fettgewebe ab
Bei hohem Angebot an Energieträgern sezerniert Fettgewebe Leptin,
dieses hemmt orexigene und fördert anorexigene Mechanismen im
Hypothalamus und wirkt dadurch mehrfach
appetitzügelnd. Bei mangelnder Energieverfügbarkeit sinkt die
Leptinbildung, das befeuert den Hunger. Leptin wirkt auch im
Immunsystem. Die Synthese von Visfatin korreliert mit dem Grad einer
Adipositas. Umgekehrt nimmt die Bildung von Adiponektin mit der Masse
an Fettgewebe ab Bei der Blutdruckregulation spielen die Einflüsse von Leber, Nieren,
Nebennieren und Gehirn zusammen: So bilden Hepatozyten Angiotensinogen
und die Nieren Renin; treffen diese aufeinander, entsteht Angiotensin
I, das vor allem in der Lunge (ACE: Angiotensin converting enzyme) zu
Angiotensin II wird. Dieses erhöht die Aktivität des Sympathikus,
fördert die Aldosteronbildung und steigert den Blutdruck teils direkt
(Vasokonstriktion), teils über eine Erhöhung des extrazellulären
Volumens
Bei der Blutdruckregulation spielen die Einflüsse von Leber, Nieren,
Nebennieren und Gehirn zusammen: So bilden Hepatozyten Angiotensinogen
und die Nieren Renin; treffen diese aufeinander, entsteht Angiotensin
I, das vor allem in der Lunge (ACE: Angiotensin converting enzyme) zu
Angiotensin II wird. Dieses erhöht die Aktivität des Sympathikus,
fördert die Aldosteronbildung und steigert den Blutdruck teils direkt
(Vasokonstriktion), teils über eine Erhöhung des extrazellulären
Volumens Im Bewegungssystem erfolgt eine enge Zusammenarbeit der beteiligten
Gewebe: Muskelkraft stärkt den Knochen, Knochen unterstützen und
verteilen die Muskelkraft, und die Gelenke bieten eine Erweiterung der
Freiheitsgrade. Myokine wirken nicht nur auf Myozyten, sondern auch auf
andere Zellen, z.B. im Knochen
Im Bewegungssystem erfolgt eine enge Zusammenarbeit der beteiligten
Gewebe: Muskelkraft stärkt den Knochen, Knochen unterstützen und
verteilen die Muskelkraft, und die Gelenke bieten eine Erweiterung der
Freiheitsgrade. Myokine wirken nicht nur auf Myozyten, sondern auch auf
andere Zellen, z.B. im Knochen Der Glutamin-Glutamat-Mechanismus (die Nieren bilden aus Glutamin, das
aus dem hepatischen Stoffwechsel stammt, Glutamat und Ammonium)
unterstützt die Stickstoffausscheidung und die Säure-Basen-Regulation
des Körpers
Der Glutamin-Glutamat-Mechanismus (die Nieren bilden aus Glutamin, das
aus dem hepatischen Stoffwechsel stammt, Glutamat und Ammonium)
unterstützt die Stickstoffausscheidung und die Säure-Basen-Regulation
des Körpers "Verdauungshormone" werden nicht nur im gastrointestinalen System,
sondern auch im Gehirn synthetisiert; sie wirken in beiden Systemen.
Cholezystokinin, pankreatisches Polypeptid, Amylin, Glucagon-like
peptide, Ghrelin, Leptin, Insulin werden je nach Stoffwechsellage
freigesetzt und beeinflussen das Gehirn
"Verdauungshormone" werden nicht nur im gastrointestinalen System,
sondern auch im Gehirn synthetisiert; sie wirken in beiden Systemen.
Cholezystokinin, pankreatisches Polypeptid, Amylin, Glucagon-like
peptide, Ghrelin, Leptin, Insulin werden je nach Stoffwechsellage
freigesetzt und beeinflussen das Gehirn Auch im Mineralhaushalt kooperieren verschiedene Organe. Steigt
beispielsweise der Plasma-Kaliumspiegel plötzlich an, wie bei starken
Muskelverletzungen, nehmen zunächst Körperzellen Zellen vermehrt Kalium
auf (Normalisierung des Plasmaspiegels), dann scheiden die Nieren -
hormongesteuert (Nebennieren) - Kalium mit dem Harn aus
Auch im Mineralhaushalt kooperieren verschiedene Organe. Steigt
beispielsweise der Plasma-Kaliumspiegel plötzlich an, wie bei starken
Muskelverletzungen, nehmen zunächst Körperzellen Zellen vermehrt Kalium
auf (Normalisierung des Plasmaspiegels), dann scheiden die Nieren -
hormongesteuert (Nebennieren) - Kalium mit dem Harn aus |
