

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Dioptrischer
Apparat, Augeninnendruck, Sehvermögen
Dioptrischer
Apparat, Augeninnendruck, Sehvermögen
© H. Hinghofer-Szalkay

Anisokorie: ἀ(v) = Verneinung, ἴσος = gleich (viel), ϰόϱη = Pupille
Aphakie: φακός (Augen-)Linse: Linsenlosigkeit
Astigmatismus: ἁ = Verneinung, στἰζω = stechen, brandmarken > στíγμα = Brandmal (kein Brennpunkt)
Budge's center: Julius Budge
Ciaccio-Drüsen: Giuseppe Vincenzo Ciaccio (1824-1901), italienischer Anatom und Histologe
Descemet-Membran: Jean Descemet
Dioptrie: διοπτρα = Hindurchseh-Instrument ("Hindurchsehung")
Edinger-Westphal-Kern: Ludwig Edinger, Carl Westphal
Emmetropie: ἔμμετρος = im Maße (passend), ὤψ = Auge
Glaukom: γλαυκός = hell, bläulich (Aristoteles: blau-graue Verfärbung der Regenbogenhaut bei chronischen Entzündungen)
Horner-Syndrom (Trias Ptosis - Miosis - Enophthalmus): Johann Friedrich Horner
Isokorie: ἴσος = gleich, ϰόϱη = Pupille
Iris: ἴρις = Regenbogen
Katarakt:
καταρράττειν = herabstürzen (Humoralpathologie: Vorstellung hinter der
Pupille "herabfließender", die Sicht verstellender Stoffe)
Krause-Drüsen: Karl Friedrich Theodor Krause
Meibom-Drüsen: Heinrich Meibom
Miosis: μειόω = klein machen, verringern (Meiosis = Verkleinerung!)
Moll-sche Drüsen: Jakob Antonius Moll (1832-1914)
Mydriasis: μυδρίασις - vielleicht von ἀμυδρὀς = dunkel, schwer zu erkennen
Myopie: μυωπία von μύω = sich schließen (der Kurzsichtige "blinzelt", um die Randstrahlen zu minimieren)
Phakoemulsifikation: φακός = (Augen-)Linse, emulgere (lat) = ausschöpfen, abmelken
Presbyopie: πρέσβυσ = alt, ὤψ = Auge
Ptosis: πτῶσις = Senkung
Pupille: Wahrscheinlich von pupilla = Püppchen (eigenes Spiegelbild im Auge des Gegenüber)
Schirmer-Test: Otto Schirmer
Schlemm'scher Kanal: Friedrich Schlemm
Tenon-Kapsel: Jaques René Tenon
Tonometrie: τόνος = Druck, Spannung; μέτρον = Maß
Wolfring-Drüsen: Emilj von Wolfring (1832-1906), polnischer Ophthalmologe
Zeis-Drüsen: Eduard Zeis
Zinn-Zonula: Johann Gottfried Zinn
Zykloplegie: κύκλος = Kreis, Bogen; πληγή = Schlag, Lähmung
Der am stärksten lichtbrechende Teil des Auges ist die Hornhaut (43 Dioptrien), während die Linse (19 Dioptrien) ihre Brechkraft erhöhen kann, also Akkommodation ermöglicht. Dazu kontrahiert sich der ringförmige Ziliarkörper, die Linse nimmt ihre kugelähnlichere Eigenform an (Blick auf nahe
Dinge). In Akkommodationsruhe spannt eine den Glaskörper umfassende elastische Schicht die Linse über den Ziliarkörper an und flacht sie ab (Blick auf weiter entfernte
Dinge).
Ist die Brechkraft relativ zur Augenlänge zu hoch (Kurzsichtigkeit, Myopie), entstehen scharfe Bilder vor (statt auf) der Netzhaut; ein Minus-Glas schafft Abhilfe. Ist das Auge verkürzt (Weitsichtigkeit, Hyperopie), kann die mangelnde Brechkraft mittels einer Sammellinse (Plus-Glas) kompensiert werden.
Die Akkommodationsbreite
(bei Kindern bis 11 Dioptrien; die Brechkraft der Linse steigt dadurch
auf 30 dptr) nimmt mit zunehmendem Alter bis auf <1 dptr ab
(Alterssichtigkeit, Presbyopie). Bei
Betrachtung naher Gegenstände hilft dann ein Plusglas ("Lesebrille") -
Alterssichtigkeit ist Akkommodationsschwäche (nicht Weitsichtigkeit).
Die Pupillenweite beeinflusst den Lichtdurchtritt in das Auge (Pupillenreflex); Mydriasis ist eine Erweiterung (sympathisch-noradrenerg), Miosis eine Verengung der Pupille (parasympathisch-cholinerg bedingt).
Die Anpassung an wechselnden Lichtfluss (Hell-Dunkel-Adaptation) erfolgt teilweise (rasch) über den Pupillenreflex, aber hauptsächlich (langsamer, dafür ausgiebiger) neuronal. Zapfen in der Netzhaut sind auf hohe Lichtstärke getrimmte Zellen, die Farbdiskriminierung erlauben; Stäbchen funktionieren bei niedriger Lichtstärke (z.B. Sternenlicht), sie sind farbunempfindlich.
Die Form des Auges wird durch den Augeninnendruck (~2 kPa) aufrechterhalten; Tonometrie misst diesen Druck. Er entsteht durch die Produktion von Kammerwasser im Ziliarkörper gegen einen Abflusswiderstand im Kammerwinkel. Ist der Druck (wegen behinderten Abflusses) erhöht (Glaukom), behindert das die Netzhautdurchblutung und kann zu Sehstörung - Skotome bis bis hin zu Blindheit - führen.
Die isotone, sauerstoffdurchlässige Tränenflüssigkeit
(pH=7,4) schützt das Auge, dem sie mehrschichtig anliegt (abdeckende
Lipidschicht außen, immunaktive Flüssigkeitsschicht darunter,
Mucinschichte direkt an der Hornhaut). Über die basale Sekretion hinaus
kann die Tränenproduktion reflektorisch gesteigert werden (Schutz durch
Weiterspülen von Irritantien).
|
Auge, Lider, Augenmuskeln  Hornhaut
Hornhaut  Tränensystem
Tränensystem  Visusbestimmung
Visusbestimmung  Linse
Linse  Akkommodation
Akkommodation  Fehlsichtigkeiten
Fehlsichtigkeiten  Pupille, Miosis, Mydriasis
Pupille, Miosis, Mydriasis  Kammerasser & Augeninnendruck
Kammerasser & Augeninnendruck
 Dioptrie
Dioptrie  Prätectum
Prätectum
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Die
Hälfte aller bewusst perzipierter Sinnesinformation stammt von der
Netzhaut, ist visueller Natur. Die Qualität der retinalen Abbildung
hängt - abgesehen von der Lichtleitung vom betrachteten Gegenstand bis
zum Auge - von optischen Eigenschaften des lichtbrechenden Systems ab
(dioptrischer Apparat: Hornhaut, Augenkammern, Linse, Glaskörper) sowie
von der Fähigkeit des Auges, bei wechselndem Abstand zum betrachteten
Gegenstand eine scharfe Abbildung zu erzielen (Akkommodation).
Sinkendes Akkommodationsvermögen mit zunehmendem Lebensalter
(Presbyopie) reduziert diese Fähigkeit. Verringerte ("Weitsichtigkeit")
oder überhöhte Brechkraft in Relation zum Augendurchmesser
("Kurzsichtigkeit") können mit entsprechenden "Plus"- oder
"Minus"-Gläsern korrigiert werden, bis zu einem gewissen Maß auch
Astigmatismen, bei denen kein klarer Brennpunkt mehr auftritt
("Zylindergläser").
Der Gesichtssinn passt sich an verschiedene Bedingungen an
 Sehen, Gesicht (idg.) *seku (sehen, mit den Augen folgen)
Sehen, Gesicht (idg.) *seku (sehen, mit den Augen folgen)
Augenlider  Augenmuskeln
Augenmuskeln
Das
Auge
(Volumen 6-7 ml) liegt gut geschützt in der knöchernen Orbita
(Augenhöhle), fixiert durch diverse bindegewebige Strukturen
(Periorbita, Augenfaszien) und das umgebende bzw. dazwischen
eingelagerte Fettpolster. Volumen und Form des Augapfels - wichtig für
die optischen Eigenschaften - sind durch die relativ formkonstante
Lederhaut (Sclera) sowie vor allem den Augeninnendruck von etwa 2 kPa
(20 cm H2O, 15 mmHg) gewährleistet.
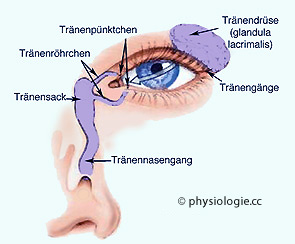
 Abbildung: Tränenwege
Abbildung: Tränenwege
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Tränenflüssigkeit
wird in der Tränendrüse gebildet, gelangt über die Tränengänge in den
Bindehautsack, wo sie als Tränensee (lacus lacrimalis) über die
Vorderfläche des Auges streicht (die Bindehaut der Horn- und Lederhaut
befeuchtet) und an den Tränenpünktchen (puncta lacrimalia) in
Tränenröhrchen (canaliculi lacrimalia) und Tränensack (saccus
lacrimalis) gelangt, um schließlich über den Tränennasengang (Tränenkanal, ductus nasolacrimalis) in die
Nase zu gelangen

In die Periorbita eingelagerte glatte
Muskulatur (m. orbitalis)
spannt unter sympathischem Einfluss den periorbitalen bindegewebigen
Stützapparat an und drückt dadurch den Augapfel etwas nach außen. Bei Ausfall des orbitalen Sympathikustonus - Horner-Syndrom  - sinkt der Augapfel ein wenig in die Augenhöhle zurück (Enophthalmus).
- sinkt der Augapfel ein wenig in die Augenhöhle zurück (Enophthalmus).
Der Aufapfel (bulbus oculi) selbst verfügt über
 einen dioptrischen
einen dioptrischen  Apparat - Hornhaut (cornea), Linse (lens),
Glaskörper (corpus vitreum) - für Lichtbrechung, Lichtleitung, Bildentstehung,
Apparat - Hornhaut (cornea), Linse (lens),
Glaskörper (corpus vitreum) - für Lichtbrechung, Lichtleitung, Bildentstehung,
 Sinnes-und Nervenzellen in
der Netzhaut zur Aufnahme, Verarbeitung und Leitung optischer
Information, sowie
Sinnes-und Nervenzellen in
der Netzhaut zur Aufnahme, Verarbeitung und Leitung optischer
Information, sowie
 einen Hilfsapparat.
einen Hilfsapparat.
Augenlider und Wimpernschlag
Die Lider (palpebrae, eyelids) schlagen im Durchschnitt alle ~3-5 Sekunden (Lidschlag) und verteilen so Drüsensekrete und Tränenflüssigkeit (Schutz vor Austrocknen) auf der Bindehaut (conjunctiva). Sie enthalten u.a. den von N. oculomotorius (III) innervierten quergestreiften Lidheber (m. levator palpebrae) sowie den sympathisch innervierten glattmuskulären m. tarsalis. Letzterer wird bei einem Ausfall der sympathischen Versorgung des Auges (Horner-Syndrom) nicht mehr tonisiert, was zu einem leichten Absinken (Ptosis  ) des Oberlids führt.
) des Oberlids führt.

 Abbildung: Augenlid und Bindehaut
Abbildung: Augenlid und Bindehaut
Nach einer Vorlage in Kumar / Abbas / Fausto / Aster,
Robbin and Cotran's Pathological Basis of Disease, 8th ed. Saunders /
Elsevier 2010
Die Vorderkammer (anterior chamber) befindet sich vor, die Hinterkammer hinter der Iris (=Regenbogenhaut)
 Die Lider enthalten mehrere Drüsen zur Befeuchtung und "Schmierung":
Die Lider enthalten mehrere Drüsen zur Befeuchtung und "Schmierung":

 Meibom-sche Drüsen
Meibom-sche Drüsen  (Tarsal-, Talgdrüsen), die am Innenrand der Lider eine ölige Flüssigkeit (>Abbildung unten) sezernieren;
(Tarsal-, Talgdrüsen), die am Innenrand der Lider eine ölige Flüssigkeit (>Abbildung unten) sezernieren;
 Moll-sche Drüsen
Moll-sche Drüsen  (gll. ciliares conjunctivales,
Wimperndrüsen), apokrine Schweißdrüsen, die zwischen den beiden anderen
Ausführungsgängen münden; und
(gll. ciliares conjunctivales,
Wimperndrüsen), apokrine Schweißdrüsen, die zwischen den beiden anderen
Ausführungsgängen münden; und
 Zeis-sche Drüsen
Zeis-sche Drüsen  , Talgdrüsen, die eine ölige Flüssigkeit in den Mittelteil der Wimpern-Haarfollikel freisetzen
, Talgdrüsen, die eine ölige Flüssigkeit in den Mittelteil der Wimpern-Haarfollikel freisetzen
 "Augentropfen" werden meist in den - gut vaskularisierten - unteren Bindehautsack (fornix inferior, inferior cul-de-sac)
appliziert. Von hier aus werden Medikamente relativ rasch resorbiert,
abhängig von Verweildauer (Tränenabfluss), Bindung an
Begleitstrukturen, Diffusionskonstante u.a. Mit der Tränenflüssigkeit
gelangen applizierte Pharmaka - über das nasolakrimale System - auf die
Nasenschleimhaut, die ebenfalls gutes Resorptionsvermögen aufweist.
"Augentropfen" werden meist in den - gut vaskularisierten - unteren Bindehautsack (fornix inferior, inferior cul-de-sac)
appliziert. Von hier aus werden Medikamente relativ rasch resorbiert,
abhängig von Verweildauer (Tränenabfluss), Bindung an
Begleitstrukturen, Diffusionskonstante u.a. Mit der Tränenflüssigkeit
gelangen applizierte Pharmaka - über das nasolakrimale System - auf die
Nasenschleimhaut, die ebenfalls gutes Resorptionsvermögen aufweist.
In das Auge eingetropfte Pharmaka können drei Wege nehmen:
Transcorneal (Hornhaut → Kammerwasser → Iris → Kreislauf),
Transconjunctival (Bindehaut → Sclera → Ziliarkörper → Kreislauf) oder via Gewebe und Gefäßwände in den Kreislauf.
Wimpernschlag (Blinzeln):
Um die Horn- und Bindehaut des vorderen Auges regelmäßig zu befeuchten
(Schutz vor Austrocknung) und die Reinigung von partikulären
Beimengungen (Staub, Pollen etc) durch beschleunigten Abtransport über
die Tränenwege zu beschleunigen, kontrahiert sich der palpebrale Teil des musculus orbicularis oculi
spontan mehrmals (10-15mal) pro Minute. Diese besonders rasche, bewusst
kaum wahrnehmbare Kontraktion dauert sehr kurz (0,1 bis höchstens 0,4
Sekunden) und stellt die rascheste Verkürzung eines Muskels im
menschlichen Körper dar.
Lidschlussreflex:
Mechanische (Fremdkörper) sowie starke optische (Blendung) oder
akustische Reize (Knall) führen automatisch zum Schließen der
Augenspalte durch den ringförmigen Augenschließmuskel (Orbicularis-oculi-Reflex); zusätzlich wird die Hornhaut durch Aufwärts-außen-bewegen des Bulbus geschützt (Bell-Phänomen, bleibt auch bei einer Fazialislähmung bestehen), und die Pupille verengt sich (Westphal-Piltz-Phänomen).
Die äußeren Augenmuskeln
sind besonders präzise Skelettmuskeln mit kleinen motorischen Einheiten
und werden durch den III. (oculomotorius), IV. (trochlearis) und VI.
(abducens) Hirnnerv gesteuert (s. dort).
Hornhaut (Cornea)
Bei der Hornhaut unterscheidet man 5 bis 6 Schichten ( Abbildung) mit jeweils unterschiedlicher Funktion:
Abbildung) mit jeweils unterschiedlicher Funktion:
 Abbildung: Vorderes Auge - Hornhaut, Augenkammern, Ziliarkörper
Abbildung: Vorderes Auge - Hornhaut, Augenkammern, Ziliarkörper
Nach einer Vorlage bei Riordan-Eva P, Whitcher EP
(eds): Vaughan & Ashbury's General Ophthalmology, 17th ed,
McGraw-Hill New York 2008
Die
Tenon-Kapsel ist eine dünne bindegewebige Hülle, die den Augapfel
umspannt und Bewegungen des Bulbus gegen seine Umgebung erleichtert.
Der Ziliarkörper besteht aus
einer pars plicata mit 70-80 Ziliarfortsätzen, und einer dorsolateral
davon gelegenen pars plana. Der Ziliarmuskel enthält eine äußere
Längs-, mittlere radiäre, und innere zirkuläre Schicht.
Kontraktion des Ziliarmuskels bewirkt Zug am Sclerasporn,
weitet die Spalten des trabekulären Netzwerks und senkt den
Strömungswiderstand - deshalb erleichtert parasympathische Reizung den
Abfluss des Kammerwassers und senkt den Augeninnendruck

 Das aus 5-6 Zellschichten bestehende Epithelschicht ist ~50 µm dick und hat eine wichtige Barrierefunktion. Sie enthält u.a. dendritische Zellen für die Immunabwehr (nach Antigenkontakt wandern sie in regionale Lymphknoten).
Das aus 5-6 Zellschichten bestehende Epithelschicht ist ~50 µm dick und hat eine wichtige Barrierefunktion. Sie enthält u.a. dendritische Zellen für die Immunabwehr (nach Antigenkontakt wandern sie in regionale Lymphknoten).
Oberflächlich
liegen mit Mikrovilli ausgestattete Epithelzellen ( Abbildung
unten), sie korrespondieren mit dem Tränenfilm, den sie vermutlich
stabilisieren. Die hochprismatische, mitotisch aktive basale Zellschicht liefert frisches Epithel nach und liegt auf der
Abbildung
unten), sie korrespondieren mit dem Tränenfilm, den sie vermutlich
stabilisieren. Die hochprismatische, mitotisch aktive basale Zellschicht liefert frisches Epithel nach und liegt auf der
 Bowman-Membran
(lamina limitans anterior), die - etwas mehr als 10 µm dick - aus
Kollagenfasern und Proteoglykanen besteht. Darunter liegt das
Bowman-Membran
(lamina limitans anterior), die - etwas mehr als 10 µm dick - aus
Kollagenfasern und Proteoglykanen besteht. Darunter liegt das
 Stroma,
mit knapp 0,5 mm Dicke der voluminöseste Hornhautanteil (90%). Es ist
hydrophil und besteht aus - von langgestreckten, synzytiären
Keratinozyten gebildeten - Kollagenlamellen, die gitterförmig
angeordnet sind, ferner Proteoglykanen und Glykosaminoglykanen. Dadurch
ist ein hoher Wasseranteil und gute optische Transparenz gegeben. Das Stroma
enthält auch Immunzellen und Nervenfasern, der Zellanteil beträgt nur
wenige Prozent. Ganz innen befindet sich eine 15µm dünne, aber
reißfeste (bis 2 bar belastbare) Schicht (Dua-Schicht).
Stroma,
mit knapp 0,5 mm Dicke der voluminöseste Hornhautanteil (90%). Es ist
hydrophil und besteht aus - von langgestreckten, synzytiären
Keratinozyten gebildeten - Kollagenlamellen, die gitterförmig
angeordnet sind, ferner Proteoglykanen und Glykosaminoglykanen. Dadurch
ist ein hoher Wasseranteil und gute optische Transparenz gegeben. Das Stroma
enthält auch Immunzellen und Nervenfasern, der Zellanteil beträgt nur
wenige Prozent. Ganz innen befindet sich eine 15µm dünne, aber
reißfeste (bis 2 bar belastbare) Schicht (Dua-Schicht).
 Die Descemet-Membran
Die Descemet-Membran (lamina
limitans posterior) ist beim Menschen die dickste Basalmembran (bei
Neugeborenen 3 µm, bei erwachsenen Personen bis 10 µm dick). Sie wird
vermutlich vom Endothel gebildet, das sie mechanisch, chemisch und
immunologisch schützt.
(lamina
limitans posterior) ist beim Menschen die dickste Basalmembran (bei
Neugeborenen 3 µm, bei erwachsenen Personen bis 10 µm dick). Sie wird
vermutlich vom Endothel gebildet, das sie mechanisch, chemisch und
immunologisch schützt.
 Angrenzend an die vordere Augenkammer findet sich die einzellige Endothelzellschicht (~5 µm), deren Zellen mit tight junctions
verbunden sind und eine Schutzfunktion haben. Aktive Transportprozesse tragen zur
Hydratation und damit Transparenz der Hornhaut bei. Zum Kammerwasser
hin tragen die Zellen Mikrozotten, mit der Augenkammer besteht
reger Stoffaustausch.
Angrenzend an die vordere Augenkammer findet sich die einzellige Endothelzellschicht (~5 µm), deren Zellen mit tight junctions
verbunden sind und eine Schutzfunktion haben. Aktive Transportprozesse tragen zur
Hydratation und damit Transparenz der Hornhaut bei. Zum Kammerwasser
hin tragen die Zellen Mikrozotten, mit der Augenkammer besteht
reger Stoffaustausch.
Die Transparenz der Hornhaut hängt von ihrer Wassereinlagerung ab. Diese ist durch Ionentransportsysteme sowohl der äußeren (Cornea-Epithel) als auch inneren Epithelzellschicht (sogenanntes Cornea-Endothel) abhängig. Optimale Transparenz ergibt sich bei einem Druck im Hornhaut-Stroma
von -40 mmHg, also einem Dehydrations- oder Unterdruck. Dieser kann nur
durch entsprechenden Ionentransport aus der Hornhaut (vom äußeren
Epithel zur Tränenflüssigkeit, vom inneren zum Kammerwasser)
gewährleistet werden.
Dabei sind die Transportraten vom inneren Epithel
höher, und dieses Cornea-"Endothel" ist auch sehr empfindlich gegenüber
Verletzungen (z.B. durch Zellverlust infolge chirurgischer Eingriffe am
Auge) und muss möglichst geschont werden.
Insgesamt ist die Mehrzahl
der die Hornhaut innervierenden Nervenfasern (70%) polymodale Nozizeptoren
- sie werden durch mechanische, thermische (>39°C, <29°C) oder
chemische Irritation gereizt und feuern, solange der Reiz anhält (Proportionalempfindlichkeit). Die meisten von ihnen sind C-Fasern,
einige gehören zum Typ Aδ. Je 10-15% der afferenten Fasern leiten
Mechanosensibilität (sehr niedrige Reizschwelle: ~0,6 mN) und
Kälteinformation mit einer Auflösung von weniger als einem Grad (die
normale Temperatur der Hornhautoberfläche beträgt ~33°C, sie sinkt bei
evaporativem / konvektivem Wärmeverlust).
 Zum Lidschlussreflex s. dort
Zum Lidschlussreflex s. dort
Auf der Hornhaut liegt ein dreischichtiger Flüssigkeitsfilm ( Abbildung):
Abbildung):
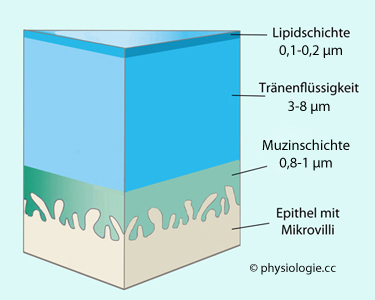
 Abbildung: Schichten auf der Hornhaut
Modifiziert nach einer Vorlage in clsspectrum.com
Abbildung: Schichten auf der Hornhaut
Modifiziert nach einer Vorlage in clsspectrum.com
Die Tränenflüssigkeit bedeckt das Corneaepithel des Auges (unten) mit einem 3-8 µm dicken Flüssigkeitsfilm. Dieser liegt auf einer 0,8-1 µm dicken Mucinschicht, welche die mit Mikrovilli versehenen Epithelzellen bedeckt und schützt.
Nach außen ist der Tränenfilm von einem hauchdünnen (0,1-0,2 µm) Fettfilm (Lipidschichte) bedeckt (oben),
die - als lipophiler Abschluss - den Verlust durch Verdunstung
minimiert und das "Ausfließen" der Tränenflüssigkeit auf die
periorbitale Haut (z.B. auf die Wange) verhindern kann

 Ganz außen findet man eine Lipidschicht, ein öliger Film, der - holokrin, d.h. unter Ruptur der Zellmembran, wobei die Zellen untergehen - von den Tarsaldrüsen
(Meibom-Drüsen)
an der Innenseite der Augenlider produziert wird. Diese Schicht deckt die darunterliegende
Flüssigkeitsschicht ab und verhindert dadurch auch das "Ausfließen" der
Tränenflüssigkeit auf die Wangen. In der Nacht (kaum Tränenproduktion)
verdicken
sich Teile dieses Films zum "Schlafsand"
Ganz außen findet man eine Lipidschicht, ein öliger Film, der - holokrin, d.h. unter Ruptur der Zellmembran, wobei die Zellen untergehen - von den Tarsaldrüsen
(Meibom-Drüsen)
an der Innenseite der Augenlider produziert wird. Diese Schicht deckt die darunterliegende
Flüssigkeitsschicht ab und verhindert dadurch auch das "Ausfließen" der
Tränenflüssigkeit auf die Wangen. In der Nacht (kaum Tränenproduktion)
verdicken
sich Teile dieses Films zum "Schlafsand"
 Die Schicht der Tränenflüssigkeit aus den Tränendrüsen dominiert mit einigen µm Schichtdicke (98% des Gesamtvolumens). Dieser hydrophile Film schützt (Immunfaktoren)
und stabilisiert die Osmolalität (Abdeckung durch die Lipidschicht verringert Verdunstung)
Die Schicht der Tränenflüssigkeit aus den Tränendrüsen dominiert mit einigen µm Schichtdicke (98% des Gesamtvolumens). Dieser hydrophile Film schützt (Immunfaktoren)
und stabilisiert die Osmolalität (Abdeckung durch die Lipidschicht verringert Verdunstung)
 Die innere Schleimschicht enthält Mucine aus Becherzellen der Bindehaut (Konjunktiva). Diese Schicht liegt direkt der Hornhaut auf und ist ebenfalls hydrophil
Die innere Schleimschicht enthält Mucine aus Becherzellen der Bindehaut (Konjunktiva). Diese Schicht liegt direkt der Hornhaut auf und ist ebenfalls hydrophil
Tränenflüssigkeit enthält Nährstoffe, Enzyme, Immunglobuline (vgl. unten); der Flüssigkeitsfilm ist durchlässig für Sauerstoff (geringe Diffusionsstrecke), was für
die Ernährung der Zellen der (gefäßlosen) Hornhaut wichtig ist.
Die
Tränenflüssigkeit wird von den Tränenwegen in die Nase abtransportiert
(punctua lacrimalia & ductus lacrimales sup. & inf., saccus
lacrimalis, ductus nasolacrimalis).
Das Tränensystem bildet und transportiert Tränenflüssigkeit (Lakrimation: lacrima = Träne, glandula lacrimalis = Tränendrüse). Tränenflüssigkeit schmiert und
schützt das Auge, versorgt dessen vorderen Teile auch mit Nährstoffen. Sie hat den gleichen Säurewert wie Blut (pH = 7,4) und ist etwa plasmaisoton (~320 mOsm/kg). Sie enthält
 Wasser (98-99%)
Wasser (98-99%)
 anorganische Salze (~1%, hauptsächlich NaCl, isoton)
anorganische Salze (~1%, hauptsächlich NaCl, isoton)
 Plasmaproteine (~0,2-0,6%, Albumin, Globuline)
Plasmaproteine (~0,2-0,6%, Albumin, Globuline)
 Glucose
(Epithelversorgung; Glucosekonzentration wie im Blutplasma - ~1 mg/ml -, kann über spezielle Kontaktlinsen
zwecks Ermittlung des Blutzuckerspiegels gemessen werden)
Glucose
(Epithelversorgung; Glucosekonzentration wie im Blutplasma - ~1 mg/ml -, kann über spezielle Kontaktlinsen
zwecks Ermittlung des Blutzuckerspiegels gemessen werden)
 Aminosäuren, Harnstoff, Amine, Dicarbonsäuren, zahlreiche weitere Metabolite
Aminosäuren, Harnstoff, Amine, Dicarbonsäuren, zahlreiche weitere Metabolite
 Mucin (~0,8 µm dicke Schutzschicht, Gleitmittel - Viskosität der Tränenflüssigkeit ~1,3 cP, zum Vergleich: Wasser <1 cP, Plasma ~2 cP)
Mucin (~0,8 µm dicke Schutzschicht, Gleitmittel - Viskosität der Tränenflüssigkeit ~1,3 cP, zum Vergleich: Wasser <1 cP, Plasma ~2 cP)
 Lipide (hydrophobe Schutzschicht). Die ~0,2 µm dicke Lipidschicht (
Lipide (hydrophobe Schutzschicht). Die ~0,2 µm dicke Lipidschicht ( Abbildung oben) enthält Cholesterin, Cholesterinester, Triglyzeride und Phospholipide
Abbildung oben) enthält Cholesterin, Cholesterinester, Triglyzeride und Phospholipide
 Lacritin - Glykoprotein aus Tränen- und Meibom- Drüsen sowie Epithelzellen in Cornea und Konjunktiva (lacrimal functional unit), auch Speicheldüsen (Lactitin ist auch im Speichel nachweisbar), sekretions- und mitosefördernd (Wundheilung) via Transkriptionsanregung
Lacritin - Glykoprotein aus Tränen- und Meibom- Drüsen sowie Epithelzellen in Cornea und Konjunktiva (lacrimal functional unit), auch Speicheldüsen (Lactitin ist auch im Speichel nachweisbar), sekretions- und mitosefördernd (Wundheilung) via Transkriptionsanregung
 Lysozym (~0,02-0,06%, greift Bakterienwände an)
Lysozym (~0,02-0,06%, greift Bakterienwände an)
 Lactoferrin (bakterizid)
Lactoferrin (bakterizid)
 Lipocaline (an Immunantworten beteiligte detoxifizierende Proteine)
Lipocaline (an Immunantworten beteiligte detoxifizierende Proteine)
 sIgA (sekretorische Antikörper)
sIgA (sekretorische Antikörper)

Hormone (z.B. Prolaktin, ACTH)
 Enkephaline
Enkephaline
Tränenflüssigkeit enthält u.a. sekretorische IgA-Antikörper, diese schützen vor Infektionen
|
Die Zusammensetzung der Tränenflüssigkeit hängt von der
Reizursache ab. Autonome Nervenfasern versorgen Drüsenzellen und Ausführungsgänge
und steuern Produktion und Aufbereitung des Sekrets. Die Steuerung der Sekretion erfolgt über muskarinisch-parasympathische (Azetylcholin plus VIP) und sympathische Fasern (Noradrenalin plus NPY). Zusätzlich können Enkephaline die Tränensekretion über δ-Opioidrezeptoren beeinflussen.
Man unterscheidet basale, reflektorisch ausgelöste, sowie emotionale Tränenproduktion:
 Basale Tränensekretion
Basale Tränensekretion
(~1 ml/Tag - Kinder ~80 µl/h, Erwachsene ~40 µl/h) hält das Auge
angefeuchtet,
schützt und versorgt es mit
Nährstoffen (Schirmer-Test s.
unten). Basale Tränenbildung erfolgt unabhängig von
sensorischen Anreizen.
Akzessorischen Tränendrüsen unter den
Augenlidern übernehmen die basale Tränensekretion:

Muköse
Krause-sche  Drüsen
Drüsen
am Übergang zwischen der oberen und unteren Bindehaut, etwa 40 im
Bereich des Oberlids und 6-8 im Bereich des Unterlids, ihre
Ausführungsgänge vereinigen sich und münden in die fornix conjunctivae;
 Wolfring
Wolfring-

bzw.
Ciaccio-

Drüsen im Bereich der caruncula lacrimalis, größer als die Krause-Drüsen, aber weniger zahlreich (3-5).
Reflektorisch oder emotional ausgelöste Tränensekretion erfolgt
durch die glandula lacrimalis, die dem Augapfel oben-lateral aufliegt:
 Reflektorische
Reflektorische Tränensekretion wird
über sensorische Afferenzen von Horn- und Bindehaut angeregt und hilft beim
Wegspülen oder Neutralisieren von Irritantien (
Reizgase,
Staub etc). Sie wird unterstützt durch Vasodilatation / erhöhte Durchblutung
der Tränendrüsen. Die
parasympathische Efferenz lauft über den N. facialis und schaltet im
ggl. pterygopalatinum um ( Abbildung).
Abbildung).
 Emotional
Emotional angeregte Sekretion (
Weinen)
wird durch höhere Gehirnteile ausgelöst und hat soziale Bedeutung
(sie regt z.B.
protektives
Verhalten an, Beispiel: Weinen Frauen, reduziert das Aggression und Sexualantrieb
bei Männern). Die Intensität der Tränensekretion liegt beim Weinen um zwei Zehnerpotenzen über derjenigen der basalen Tränenproduktion.
Die Konzentration von Hormonen in den Tränen scheint höher zu sein als bei reflektorisch ausgelöstem Tränenfluss.
Eine Neuronengruppe im oberen nucleus salivatorius
(dieser Unterabschnitt wird manchmal als nucleus lacrimalis
bezeichnet),
auf welche höhere Zentren projizieren (präfronater Cortex, limbisches
System) und so direkt auf die Tränensekretion einwirken können (  Abbildung), löst emotional bedingte Tränensekretion aus. Die neuronalen Strukturen, die viszeromotorische,
neuroendokrine und Verhaltensreaktionen kontrollieren, fasst man als zentrales autonomes Netzwerk (central autonomic network CAN) zusammen. Dieses verwaltet emotionale Vorgänge und umfasst u.a.
Präfrontalrinde und limbisches System (Gefühle), Basalganglien und
Thalamus (motorische Gefühlsäußerungen), Hypothalamus (neuroendookrine
Reaktionen), zentrales Höhlengrau (Schmerzmanagement).
Abbildung), löst emotional bedingte Tränensekretion aus. Die neuronalen Strukturen, die viszeromotorische,
neuroendokrine und Verhaltensreaktionen kontrollieren, fasst man als zentrales autonomes Netzwerk (central autonomic network CAN) zusammen. Dieses verwaltet emotionale Vorgänge und umfasst u.a.
Präfrontalrinde und limbisches System (Gefühle), Basalganglien und
Thalamus (motorische Gefühlsäußerungen), Hypothalamus (neuroendookrine
Reaktionen), zentrales Höhlengrau (Schmerzmanagement).

 Abbildung: Steuerung der emotionalen Tränensekretion
Modifiziert nach Bylsma LM, Gracanin A, Vingerhoets JJM. The neurobiology of human crying. Clin Auton Res 2019; 29: 63-73
Abbildung: Steuerung der emotionalen Tränensekretion
Modifiziert nach Bylsma LM, Gracanin A, Vingerhoets JJM. The neurobiology of human crying. Clin Auton Res 2019; 29: 63-73
Das
Bild zeigt die Innervation der Tränendrüsen (sensorisch,
parasympathisch und sympathisch) sowie neuronale Strukturen, die sich
an der Steuerung des Weinens beteiligen.
Zum zentralen autonomen Netzwerk (CAN: central autonomic network) gehören Strukturen in Großhirn
(Präfrontalhirn, limbisches System), Zwischenhirn (Thalamus,
Hypothalamus) und Hirnstamm (zentrales Höhlengrau). Die meisten dieser Strukturen projizieren auf den nucleus lacrimalis, einen Teil des nucleus salivatorius superior.
Der viszeromotorische nucleus ambiguus
projiziert auf mehrere Hirnnerven (CN 9, 10, 11), wirkt u.a. auf
Sprechen und Schlucken ein, senkt die Herzfrequenz und verengt die
Bronchien
CN = cranial nerve (Hirnnerv: CN 5, N. trigeminus; CN 9, N. glossopharyngeus)

Sichtbare
Produktion von Tränen beginnt im Alter von 4-8 Wochen nach der Geburt,
die Bedeutung des Weinens als Gefühlsäußerung nimmt mit zunehmendem
Alter zu, die Frequenz (Männer weinen im Durchschnitt 1-mal, Frauen
4-5mal pro Monat) hängt wesentlich von den bewirkten sozialen Reaktionen (also vom "Erfolg" des Weinens) ab.
Emotional
ausgelöste Tränenproduktion ist nur ein Teil einer wesentlich
komplexeren motorischen Strategie zur Äußerung von Gefühlen; diese
umfasst z.B. Mimik, Atemsteuerung und die Signalwirkung der gesamten Körpersprache.
Um ein
lichtstarkes und scharfes Bild der Umwelt auf die Netzhaut projizieren
zu können, bedarf es der Ablenkung (Brechung, Refraktion) des Lichtes
im Strahlengang. Diese Aufgabe übernimmt die Hornhaut (starke
Lichtbrechung) und die Linse (anpassungsfähige Lichtbrechung).
Korrektur der Refaktion gehört zu den häufigsten augenärztlichen
Maßnahmen.
Die Brechkraft
(Refraktion) eines optischen Systems wird in Dioptrien (diopters) angegeben. Das ist zweckmäßig, weil diese Angabe
unabhängig von allfälligen Refraktionsanomalien gilt (insbesondere
Weitsichtigkeit, bei der sich der Fernpunkt formal "hinter dem
Unendlichen" befindet). Der Fernpunkt kann mittels einer optischen Linse nahe an das Auge
gerückt und der Fernpunktabstand leicht messbar werden.
Die Dioptrie (dpt) ist
der Kehrwert einer in Meter angegebenen Strecke, z.B. der Brennweite
|

 Bündelt z.B. eine Linse parallele Lichtstrahlen
(Sonnenlicht) in 1/2 m Abstand zu einem Brennpunkt, so beträgt ihre
Brechkraft 2 Dioptrien.
Bündelt z.B. eine Linse parallele Lichtstrahlen
(Sonnenlicht) in 1/2 m Abstand zu einem Brennpunkt, so beträgt ihre
Brechkraft 2 Dioptrien.
Je größer die Dioptrienzahl, desto höher das Refraktionsvermögen eines optischen Systems. So hat die Hornhaut (cornea) eine Brechkraft von 43 dpt, die Linse 19 dpt (mehr zur Linse s. unten); das Auge als zusammengesetztes System 59 dpt. (3 Dioptrien gehen in der vorderen Augenkammer "verloren", s. weiter unten.)
 Dioptrienzahlen
kann man nicht einfach zusammenzählen, es kommt auch auf die Lage der Komponenten im optischen System
an: Die Vorderfläche der Linse liegt 5,6 mm hinter derjeniger der
Hornhaut, die Linse beginnt erst ab hier mit ihrem Beitrag zur
Refraktion. Eine "Starbrille" - nach Entfernung der Linse - hat eine
entsprechend niedrigere Dioptrienzahl von 15: die Brillenlinse liegt vor,
nicht hinter der Hornhaut.
Dioptrienzahlen
kann man nicht einfach zusammenzählen, es kommt auch auf die Lage der Komponenten im optischen System
an: Die Vorderfläche der Linse liegt 5,6 mm hinter derjeniger der
Hornhaut, die Linse beginnt erst ab hier mit ihrem Beitrag zur
Refraktion. Eine "Starbrille" - nach Entfernung der Linse - hat eine
entsprechend niedrigere Dioptrienzahl von 15: die Brillenlinse liegt vor,
nicht hinter der Hornhaut.
Der Brechungsindex n (refractive index) eines optischen Mediums ( Abbildung) ist ein Maß für die Geschwindigkeit, mit der das Licht durch das Medium wandert:
Abbildung) ist ein Maß für die Geschwindigkeit, mit der das Licht durch das Medium wandert:
cv ist dabei die Lichtgeschwindigkeit in Vakuum und cm
die Lichtgeschwindigkeit im Medium (z.B. Kammerwasser).
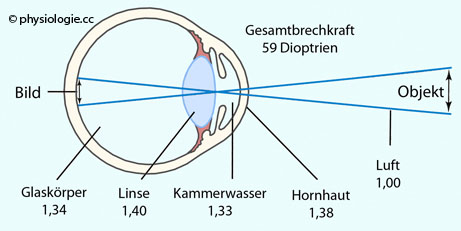
 Abbildung: Auge als optisches System
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Abbildung: Auge als optisches System
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Emmetropes Auge. Die unten angegebenen Zahlen sind Brechungsindices (gerundet - vgl. Werte in folgender Abbildung)

Wasser (1,33) und Tränenflüssigkeit (1,34) haben einen höheren Brechungsindex als Luft (1,0)
|
Je dichter das
Medium, desto langsamer passiert das Licht; je stärker das Licht
abgebremst wird, desto höher ist der Betrag des Brechungsindex. An Grenzflächen,
wo Materialien mit unterschiedlichem Brechungsindex aneinandergrenzen,
kommt es beim Medium-Übertritt des Lichts zu einer Änderung seiner
Richtung, sofern zwischen der Richtung des Lichts und der Grenzfläche
ein Winkel besteht, der nicht 90° beträgt.
Abbildungsfehler:
Die Physik der Abbildung über Linsensysteme bringt es mit sich, dass
auch im Auge verschiedene Unzulänglichkeiten bei der Abbildung der
Umwelt auf der Netzhaut auftreten.
Abhängigkeit von der Wellenlänge: Kurzwelliges Licht (blau) wird stärker gebrochen als langwelliges (rot), was bei Randstrahlen eine chromatische Aberration
(Farbsäume) bewirkt. Diese ist aber gering und macht sich im Auge kaum
bemerkbar. Allerdings muss die Linse zum Abbilden roter Gegenstände
stärker gekrümmt sein (Strahlen werden schwächer gebrochen) als zum
Abbilden blauer Dinge (Strahlen werden stärker gebrochen), was den
Eindruck erweckt, rote Gegenstände seien näher am Gesicht als blaue.
Kurzwelliges Licht wird stärker gebrochen als langwelliges
Rote Dinge scharf abzubilden erfordert daher stärkere Adaptation als grüne / blaue, die weiter vom Gesicht entfernt erscheinen als rote
|
Zu den monochromatischen Abbildungsfehlern optischer Systeme zählen die sphärische Aberration (wobei die Abweichung umso stärker ist, je weiter außen der Lichtstrahl verläuft). Auch der Astigmatismus ("Stabsichtigkeit", s. weiter unten) fällt in diese Kategorie.
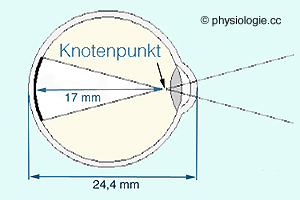
59 dpt entspricht einer Brennweite von ~17 mm (das Auge hat einen
Gesamtdurchmesser von etwa 24 mm). Übrigens beträgt der Abstand der Netzhaut zum - knapp hinter der Linse gelegenen - Knotenpunkt, durch den Objekt- und Bildraumstrahl ohne Richtungswechsel gezeichnet werden können, 17 mm (optische Achse).

 Abbildung: Struktur des Auges, Brechungsindices
Abbildung: Struktur des Auges, Brechungsindices
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
An
der Grenzfläche Luft / Cornea wird Licht besonders stark gebrochen
(Unterschied der Brechungsindices ~0,38) - vgl. Zahlenwerte in voriger
Abbildung

Der Strahlengang ist wegen der optischen Inhomogenität der Medien
(Hornhaut - vordere Augenkammer - Linse - Glaskörper) komplex und kann
durch Vereinfachungskonstruktionen (Hauptlinien; "reduziertes" Auge) charakterisiert
werden. Beim normalsichtigen Auge gilt jedenfalls:
 Im nichtakkommodierten (Ruhe-) Zustand werden parallel eintreffende Lichtstrahlen auf der Netzhaut zu einem (Bild-) Punkt vereint (
Im nichtakkommodierten (Ruhe-) Zustand werden parallel eintreffende Lichtstrahlen auf der Netzhaut zu einem (Bild-) Punkt vereint ( Abbildung oben)
Abbildung oben)
 Im perfekt akkommodierten Zustand werden (von einem nahe am Auge liegenden Gegenstandspunkt ausgehende) divergierende Lichtstrahlen auf
der Netzhaut zu einem (Bild-) Punkt vereint. Dies ist durch die Zunahme
der Brechkraft der sich stärker abrundenden Linse bedingt (Mechanismus s. weiter unten)
Im perfekt akkommodierten Zustand werden (von einem nahe am Auge liegenden Gegenstandspunkt ausgehende) divergierende Lichtstrahlen auf
der Netzhaut zu einem (Bild-) Punkt vereint. Dies ist durch die Zunahme
der Brechkraft der sich stärker abrundenden Linse bedingt (Mechanismus s. weiter unten)
In Dioptrien gibt man auch die höchstmögliche Änderung der Brechkraft des Auges an. Diese wird als Akkommodationsbreite
(Akkommodationsamplitude) bezeichnet.
Berechnet wird diese aus dem
Unterschied zwischen Fern- und Nahpunktabstand (F, N, in m), ausgedrückt in Dioptrien (1/m): Fernpunkt
bei minimaler, Nahpunkt bei maximaler Akkommodationsanstrengung (s.
weiter unten).
Dabei wird die
Dioptrienzahl ("Stärke") der Sammellinse von der des mittels dieser
Linse ermittelten Fernpunktes abgezogen.
| Die Akkommodationsbreite wird berechnet aus [1/N - 1/F] und wird in Dioptrien angegeben
|
Beim Normalsichtigen (Emmetropen  )
liegt der Fernpunkt "im Unendlichen" (0 dptr), d.h. er bildet bei
Akkommodationsruhe fern gelegene Gegenstände scharf auf der Netzhaut ab.
Sein Fernpunkt liegt bei Verwendung einer 4 dptr-Linse bei 25 cm (1/4
m = 4 dptr).
)
liegt der Fernpunkt "im Unendlichen" (0 dptr), d.h. er bildet bei
Akkommodationsruhe fern gelegene Gegenstände scharf auf der Netzhaut ab.
Sein Fernpunkt liegt bei Verwendung einer 4 dptr-Linse bei 25 cm (1/4
m = 4 dptr).
 Beispiel: Weitsichtiger Patient (2 dptr), Nahpunkt (unkorrigiert) 20 cm. Akkommodationsbreite = ?
Beispiel: Weitsichtiger Patient (2 dptr), Nahpunkt (unkorrigiert) 20 cm. Akkommodationsbreite = ?
Fernpunkt bei Verwendung einers +4 dptr-Glases 50 cm (1/2 m = 2 dptr)
statt 25 cm, da Patient 2 dptr hypermetrop (4-2!) → Fernpunkt -2 dptr;
Nahpunkt +5 dptr (20 cm = 1/5 m) → Akkommodationsbreite (Abstand Fernpunkt - Nahpunkt in dptr) = 7 Dioptrien (Distanz von -2 zu +5).
Retinales Auflösungsvermögen:
 Zentrales Sehen: 1 Bogengrad bedeutet auf der Netzhaut eine Strecke von 300 µm. In der fovea centralis (Durchmesser 300-700 µm) sind die Rezeptoren (die Fovea ist ausschließlich mit Zapfen bestückt) am dichtesten gepackt - Abstand etwa 0,3 µm - und
sie sind zu ihren Ganglienzellen 1:1 verschaltet (höchstmögliche Auflösung). Bilden sich hier zwei Punkte so ab, dass zwei betroffene Zapfen durch einen nicht betroffenen
getrennt sind, entspricht das einem Abstand von einer Bogenminute.
Zentrales Sehen: 1 Bogengrad bedeutet auf der Netzhaut eine Strecke von 300 µm. In der fovea centralis (Durchmesser 300-700 µm) sind die Rezeptoren (die Fovea ist ausschließlich mit Zapfen bestückt) am dichtesten gepackt - Abstand etwa 0,3 µm - und
sie sind zu ihren Ganglienzellen 1:1 verschaltet (höchstmögliche Auflösung). Bilden sich hier zwei Punkte so ab, dass zwei betroffene Zapfen durch einen nicht betroffenen
getrennt sind, entspricht das einem Abstand von einer Bogenminute.
 Außerhalb der Fovea nimmt die Dichte der Zapfen sehr rasch ab, es überwiegen Stäbchen. Beide zusammen vermitteln das periphere Sehen. Hier herrscht das Prinzip der Konzergenz
(viele Photorezeptoren projizieren auf jeweils eine Ganglienzelle).
Dabei werden in der Netzhaut z.B. Bewegungen detektiert, die dann die
Aufmerksamkeit auf sich richten (Fixierung der betreffenden Stelle auf
die Fovea).
Außerhalb der Fovea nimmt die Dichte der Zapfen sehr rasch ab, es überwiegen Stäbchen. Beide zusammen vermitteln das periphere Sehen. Hier herrscht das Prinzip der Konzergenz
(viele Photorezeptoren projizieren auf jeweils eine Ganglienzelle).
Dabei werden in der Netzhaut z.B. Bewegungen detektiert, die dann die
Aufmerksamkeit auf sich richten (Fixierung der betreffenden Stelle auf
die Fovea).
Die (anguläre) Sehschärfe (der Visus, visual acuity)
wird als der Kehrwert des Auflösungsvermögens (quantifiziert in
Winkelminuten) der fovea centralis definiert. (Peripher davon nimmt das
Auflösungsvermögen rapide ab, weshalb man betrachtete Gegenstände immer
auf die fovea abzubilden trachtet: Blickmotorik.)
In der Praxis gilt: Visus = Abstand (ist) / Abstand (soll),
wobei der Abstand gemeint ist, den die untersuchte Person von einer
Sehprobentafel hat. Die Zeilen auf dieser Tafel haben (klein
dargestellte) Indexnummern, z.B. bedeutet die Zahl "6", dass ein
Normalsichtiger (mit einem Visus von 1, d.h. Normalsichtigkeit oder
Emmetropie) die Symbole in dieser Zeile aus 6 m Abstand noch korrekt
erkennen kann.
Der Visus wird je Auge getrennt geprüft (bei Brillenträgern mit
Brille, wenn deren Tauglichkeit geprüft werden soll), das jeweils andere Auge wird verdeckt.
 Ein Patient erkennt Testmuster in der Zeile mit dem Index "6" nur aus
≤3 m Entfernung. Sein Visus beträgt? ... 0,5 (3:6)
Ein Patient erkennt Testmuster in der Zeile mit dem Index "6" nur aus
≤3 m Entfernung. Sein Visus beträgt? ... 0,5 (3:6)
 Sehprobentafeln enthalten Reizmuster (Optotypen, z.B. Buchstaben, Zahlen, Ringe, Haken..) mit normierten Balkenbreiten bzw. Lücken (aus entsprechendem Abstand betrachtet eine Winkelminute Größe,
Sehprobentafeln enthalten Reizmuster (Optotypen, z.B. Buchstaben, Zahlen, Ringe, Haken..) mit normierten Balkenbreiten bzw. Lücken (aus entsprechendem Abstand betrachtet eine Winkelminute Größe,  Abbildung):
Abbildung):
 Buchstaben
Buchstaben
 Zahlen
Zahlen
 Pflüger-Haken (nach welcher Seite offen?)
Pflüger-Haken (nach welcher Seite offen?)
 Landolt-Ringe (wohin ist die Lücke gerichtet?)
Landolt-Ringe (wohin ist die Lücke gerichtet?)
 Kinderbilder
Kinderbilder
Das Grundelement (Dicke der Zeichen, Abstand bei den Landolt-Ringen) ist dabei jeweils eine Bogenminute (Winkelminute) groß. Die Kriterien bei der Bestimmung des Auflösungsvermögens können außer dem kleinsten Winkel (minimum separabile) auch andere sein: Kontur / Kontrast (minimum visibile), kleinster Unterschied (minimim discriminibile), Lesesehschärfe (minimum legibile).
| Bei Normalsichtigkeit (Emmetropie) beträgt der Visus 1,0 |
 Der Visus beträgt >1 (erforderlicher retinaler Mindestabstand
kleiner als 5 µm), wenn das Auflösungsvermögen der Netzhaut
überdurchschnittlich hoch ist ("Adlerblick").
Der Visus beträgt >1 (erforderlicher retinaler Mindestabstand
kleiner als 5 µm), wenn das Auflösungsvermögen der Netzhaut
überdurchschnittlich hoch ist ("Adlerblick").
Die Linse
(crystalline lens) hat einen Durchmesser (equatorial thickness) von 9-10 mm, ist 4-5 mm dick (axial thickness) und besteht aus einer Kapsel (capsula lentis), einer Rinde (cortex lentis) und einem Kern (nucleus lentis). Die Kapsel der Linse besteht aus parallel
angeordneten bindegewebigen Filamenten
aus Kollagen (Typ IV), Laminin, Perlecan, Fibronectin, Proteoglykanen
und ist in der Äquatorialzone am stärksten, am posterioren Pol am
schwächsten ausgebildet. Die vordere Seite der Linse ist flacher
(schwächer gekrümmt) als die posteriore. Man unterscheidet einen
anterioren und einen posterioren Linsenpol sowie den Äquator der
Linse.
Extrazelluläre Flüssigkeit bewegt sich von den Linsenpolen durch
das Gewebe zum Äquator und transportiert dabei Wasser, Ionen,
Nährstoffe und Metabolite. Das osmotische Gleichgewicht wird durch
Aktivität der Na/K-Pumpe vorwiegend der Zellen der Äquatorialzone
aufrecht erhalten. Die Masse der Linse nimmt im Laufe des Lebens stetig zu (Neugeborene 65 mg, 10 a
160 mg, 90 a 250 mg).

 Abbildung: Interdigitierende Zellfortsätze sichern die wechselseitige Positionierung von Linsenfaserzellen
Abbildung: Interdigitierende Zellfortsätze sichern die wechselseitige Positionierung von Linsenfaserzellen
Nach einer Vorlage bei Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
Elektronenmikroskopische Darstellung von Zellen einer menschlichen Linse. Die 4-7 µm dicken, bis zu 12 mm langen Faserzellen
(im Bild von links vorne nach rechts hinten orientiert) sind miteinander mechanisch so verbunden, dass sie
einerseits Formveränderungen der Linse (Akkommodation) möglichst
widerstandsfrei zulassen, andererseits ihre räumliche Anordnung behalten, was aus optischen Gründen wichtig ist.
Mechanische Stabilität bei gleichzeitig leichter Verformbarkeit wird über die hier gezeigten (an das intrazelluläre Gerüstwerk von Mikrofilamenten gekoppelten) interdigitierenden Zellfortsätze garantiert. Diese stellen eine klettverschlussartige wechselseitige Fixierung der Faserzellen her. Tight
junctions würden den Stoffaustausch über den
Extrazellulärraum behindern und kommen in der Linse so gut wie nicht
vor
 Blutgefäße und
Nerven würden die Transparenz der Linse beeinträchtigen und sind in der
normalen Linse nicht vorhanden. Der Stoffaustausch (niedrigmolekulare Nährstoffe und Metabolite, Elektrolyte u.a.) erfolgt ausschließlich über das Kammerwasser und interzellulär via gap junctions.
Die Passage von Wasser durch Zellmembranen - für die Transparenz wichtig - wird durch Aquaporine (AQP0, AQP1, AQP5) ermöglicht.
Blutgefäße und
Nerven würden die Transparenz der Linse beeinträchtigen und sind in der
normalen Linse nicht vorhanden. Der Stoffaustausch (niedrigmolekulare Nährstoffe und Metabolite, Elektrolyte u.a.) erfolgt ausschließlich über das Kammerwasser und interzellulär via gap junctions.
Die Passage von Wasser durch Zellmembranen - für die Transparenz wichtig - wird durch Aquaporine (AQP0, AQP1, AQP5) ermöglicht.
Direkt unter der Vorderseite der Kapsel liegt das einschichtige Linsenepithel,
das sich vom Rand der Linse (Linsenäquator) bis zum vorderen Linsenpol
(zentrales Epithel) erstreckt. Hier liegt die Wachstumszone (zona germinativa, germinative zone) der vorderen Linsenkurvatur mit lebenslang teilungsfähigen (Stamm-) Zellen. Diese verfügen über Zellkerne und andere Zellorganellen, um ihre mitotische Aktivität erfüllen zu können. Ihre basolateralen Pole sind nach vorne
(zur Augenkammer hin) gerichtet, die Kapsel fungiert als Basalmembran.
Aus den Zellen der germinativen Zone entwickeln sich kontinuierlich faserförmige Linsenfaserzellen (LEC, lens epithelial cells), die sich an die schon vorhandenen zwiebelschalenartig anlegen. LEC machen den größten Teil des Linsenvolumens aus; sie ziehen bogenförmig von
der Mittelliniennaht nach lateral und von dort zur Mittelliniennaht
zurück. Die ältesten (embryonalen) Zellen liegen innen und in der
Mitte, nach lateral gefolgt von fetalen und adulten Faserzellen. Reife
LEC weisen keine Zellorganellen mehr auf, enthalten aber ein stark
ausgebildetes Zytoskelett (Aktin, Myosin, Mikrotubuli etc). Sie sind bis zu 12 mm lang, 4-7 µm breit und mittels
knopfartiger Fortsätz (interdigitating processes) klettverschlussähnlich miteinander verknüpft ( Abbildung),
sodass sie der Akkommodation elastisch folgen können. Durch diese Architektur können sie ihre
Anordnung zueinander erhalten - was für die optische Qualität der Linse wichtig ist -, ohne die extrazelluläre Passage von Ionen,
Metaboliten und Nährstoffen wesentlich zu behindern. Die Zellen
enthalten transparente Strukturproteine (Crystalline), die auch in der
Hornhaut vorkommen und den optischen Refraktionsindex erhöhen.
Mit zunehmendem Lebensalter nimmt das Volumen der Rindenzone ab, das Volumen des Linsenkerns zu. Im Linsenkern ist die Konzentration an Crystallinen höher (bis zu 70%) als im Rindenbereich, nimmt aber mit dem Lebensalter ab. Oxidativer Stress verhärtet zusehends den Linsenkern, der bräunliche Farbe annimmt und dessen Lichtdurchlässigkeit im 8. Lebensjahrzehnt auf 1/10 des ursprünglichen Wertes abnimmt. Sein
Volumen nimmt durch Wassereinlagerung (welche die optischen Eigenschaften
verschlechtert, weil die Distanz zwischen den Proteinmolekülen größer
wird) zu.
Altersbedingte
Volumenzunahme und Verhärtung des Linsenkerns bedingt
Abbildung),
sodass sie der Akkommodation elastisch folgen können. Durch diese Architektur können sie ihre
Anordnung zueinander erhalten - was für die optische Qualität der Linse wichtig ist -, ohne die extrazelluläre Passage von Ionen,
Metaboliten und Nährstoffen wesentlich zu behindern. Die Zellen
enthalten transparente Strukturproteine (Crystalline), die auch in der
Hornhaut vorkommen und den optischen Refraktionsindex erhöhen.
Mit zunehmendem Lebensalter nimmt das Volumen der Rindenzone ab, das Volumen des Linsenkerns zu. Im Linsenkern ist die Konzentration an Crystallinen höher (bis zu 70%) als im Rindenbereich, nimmt aber mit dem Lebensalter ab. Oxidativer Stress verhärtet zusehends den Linsenkern, der bräunliche Farbe annimmt und dessen Lichtdurchlässigkeit im 8. Lebensjahrzehnt auf 1/10 des ursprünglichen Wertes abnimmt. Sein
Volumen nimmt durch Wassereinlagerung (welche die optischen Eigenschaften
verschlechtert, weil die Distanz zwischen den Proteinmolekülen größer
wird) zu.
Altersbedingte
Volumenzunahme und Verhärtung des Linsenkerns bedingt
 Abnahme der
Elastizität der Linse mit der Folge reduzierter Akkommodationsbreite
(Presbyopie) und Myopisierung (Korrektur: "Lesebrille"),
Abnahme der
Elastizität der Linse mit der Folge reduzierter Akkommodationsbreite
(Presbyopie) und Myopisierung (Korrektur: "Lesebrille"),
 zunehmende Verfärbung / Trübung
mit der Folge reduzierter Lichdurchlässigkeit und optischer Qualität: Katarakt, "grauer Star". Therapie: Phakoemulsifikation
zunehmende Verfärbung / Trübung
mit der Folge reduzierter Lichdurchlässigkeit und optischer Qualität: Katarakt, "grauer Star". Therapie: Phakoemulsifikation (Fraktionierung des Linkenkerns mittels Ultraschall), Absaugung der
Trümmer mittels Kanüle, Einsetzen einer künstlichen Linse mit
gewünschter Refraktion, zusätzlich Brille mit entsprechendem
Multifokalglas (die künstliche Linse kann nicht akkommodieren).
Mittels der feinen Zonulafasern (fibrae zonulares, zonular fibers / ligaments, N ~5.105, Länge bis 3 mm, 1-2 µm Durchmesser, Bündel
bis 40 µm) ist die Linse am Ziliarkörper fixiert (Zinn'sche Zonula, zonule of Zinn
(Fraktionierung des Linkenkerns mittels Ultraschall), Absaugung der
Trümmer mittels Kanüle, Einsetzen einer künstlichen Linse mit
gewünschter Refraktion, zusätzlich Brille mit entsprechendem
Multifokalglas (die künstliche Linse kann nicht akkommodieren).
Mittels der feinen Zonulafasern (fibrae zonulares, zonular fibers / ligaments, N ~5.105, Länge bis 3 mm, 1-2 µm Durchmesser, Bündel
bis 40 µm) ist die Linse am Ziliarkörper fixiert (Zinn'sche Zonula, zonule of Zinn  ). Die Zonulafasern verfügen über zugfeste Mikrofibrillen, mittels derer beständig Kraft (nach außen gerichter Zug der Zonulafasern) auf die Linsenkapsel übertragen und die Linse dadurch in einem nichtakkommodierten Zustand mit geringerer Refraktion gehalten werden kann.
Eine isolierte
Linse rundet sich entsprechend ihrer Eigenelastizität wesentlich
stärker ab als im nicht-akkommodierten Auge. (Zur Abflachung der Linse
im Auge gibt es verschiedene Modellerklärungen,
). Die Zonulafasern verfügen über zugfeste Mikrofibrillen, mittels derer beständig Kraft (nach außen gerichter Zug der Zonulafasern) auf die Linsenkapsel übertragen und die Linse dadurch in einem nichtakkommodierten Zustand mit geringerer Refraktion gehalten werden kann.
Eine isolierte
Linse rundet sich entsprechend ihrer Eigenelastizität wesentlich
stärker ab als im nicht-akkommodierten Auge. (Zur Abflachung der Linse
im Auge gibt es verschiedene Modellerklärungen,  s. z.B. Wilson 1993, Koshits et al 2020). Die exakte Biomechanik
der Kraftübertragung vom Ziliarkörper auf die Linse ist noch nicht
endgültig geklärt.
s. z.B. Wilson 1993, Koshits et al 2020). Die exakte Biomechanik
der Kraftübertragung vom Ziliarkörper auf die Linse ist noch nicht
endgültig geklärt.
Die Linse ist für die Entstehung eines scharfen Netzhautbildes unverzichtbar; Linsenlosigkeit (Aphakie) bedeutet, dass die Lichtstrahlen von Gegenstandspunkten nicht mehr auf
(nunmehr virtuell retroretinal gelegene) Abbildungspunkte auf der
Netzhaut gebündelt werden können.
bedeutet, dass die Lichtstrahlen von Gegenstandspunkten nicht mehr auf
(nunmehr virtuell retroretinal gelegene) Abbildungspunkte auf der
Netzhaut gebündelt werden können.
Ein aphakes Auge kann keine scharfen Abbildungen auf der Netzhaut erzeugen
|
Es ergibt sich
also: Hornhaut +43 dpt, Augenkammer -3 dpt, Linse +19 dpt = 59 dpt
Gesamtbrechkraft des (nicht-akkommodierten) Auges.
Anpassung der Refraktion (Akkommodation)
Wie passt das Auge - mit seiner Gesamt-Brechkraft von etwa 59 Dioptrien
(Akkommodationsruhe, d.h. Blick in die Ferne - der Augapfel des
Erwachsenen ist ca. 24 mm lang) seine Brechkraft an die optischen
Notwendigkeiten an?

(

Abbildung)
Der entspannte Ziliarmuskel (nicht akkommodierter Ruhezustand) wird
vom elastischen Gewebe des Augapfels geweitet und damit die Linse
- gegen ihr Bestreben, eine eher kugelförmige Eigenform anzunehmen - abgeflacht (gedehnt). Das reduziert die Brechkraft der Linse, sodass beim
normalsichtigen Auge entfernt liegende Gegenstände scharf auf der
Netzhaut abgebildet werden. In der
Äquatorialzone verankerte Zonulafasern (suspensory ligaments) übertragen diese Kraft vom elastischen Aufhängeapparat im Auge auf die Linse. Bei Nahakkommodation wird die Spannkraft reduziert durch die Kontraktion des ringförmigen Ziliarmuskels, die
Linse entspannt sich und nimmt mehr ihrer spontanen Kugelform an, ihre
Refraktionskraft steigt, und es können nahe am Gesicht liegende
Gegenstände scharf auf der Netzhaut abgebildet werden.

Abbildung: Mechanismus der Akkommodation
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Links: Die Linse ist über Zonulafasern am ringförmigen Ziliarmuskel befestigt.
Mitte: Der relaxierte
Ziliarmuskel wird durch den Zug (grüne Pfeile) der elastischen
Augenhülle folgend nach posterior gezogen und überträgt diese Kraft auf
die Linse, die dadurch abgeflacht wird. Ihre Brechkraft entspricht in dieser Situation bei normalsichtigen Menschen dem nicht-akkommodierten
Ruhezustand, bei dem entfernt liegende Objekte scharf auf der Netzzhaut
abgebildet werden können.
Rechts: Kontrahiert
sich der Ziliarmuskel, verringert sich sein Durchmesser, er rückt nach innen und die Zonulafasern werden entspannt.
Die Linse kann sich so ihrer runderen Eigenform annähren
(Eigenelastizität), ihre Brechkraft steigt an, nun können nahe am
Gesicht liegende Objekte scharf abgebildet werden (Akkommodation)
 Die Hornhaut
hat
die größte Brechkraft der lichtbrechenden Teile des Auges (43
Dioptrien); sie ist nicht veränderbar. Ein einschichtiges Epithel, das
die Hornhautrückfläche bedeckt, reguliert aktiv den Wassergehalt der
Hornhaut und verhindert so eine allfällige Quellung des
Hornhautstromas. Die Durchsichtigkeit wird durch die Tatsache
unterstützt, dass die Hornhaut keine Gefäße hat; ihr Kollagen ist
hochorganisiert, um Lichtstreuung zu minimieren (30 nm Durchmesser, 60
nm Abstand).
Die Hornhaut
hat
die größte Brechkraft der lichtbrechenden Teile des Auges (43
Dioptrien); sie ist nicht veränderbar. Ein einschichtiges Epithel, das
die Hornhautrückfläche bedeckt, reguliert aktiv den Wassergehalt der
Hornhaut und verhindert so eine allfällige Quellung des
Hornhautstromas. Die Durchsichtigkeit wird durch die Tatsache
unterstützt, dass die Hornhaut keine Gefäße hat; ihr Kollagen ist
hochorganisiert, um Lichtstreuung zu minimieren (30 nm Durchmesser, 60
nm Abstand).
Die Hornhaut ist das am stärksten lichtbrechende Medium des Auges (in Luft ~43 dpt)
|
Schlechtes Sehen unter Wasser: Taucht man das Auge in Wasser (Freitauchen), ist der Brechungsindex von Wasser (1,33) der Hornhaut fast
identisch mit dem vorin ihr (~1,38) sowie im Kammerwasser hinter ihr (~1,34), und die
Brechkraft der Hornhaut verschwindet so gut wie vollständig. Das
bedeutet, dass dem Auge nur noch eine Brechkraft von rund 19 Dioptrien
(Linse) verbleibt - eine Abnahme um zwei Drittel (von 59 Dioptrien).
Allerdings: Trägt man eine Taucherbrille (gerades Glas), entfällt
dieser Effekt, da sich dann vor der Hornhaut Luft (Brechungsindex 1,0)
befindet - man hat normale Sicht.
In der vorderen Augenkammer - zwischen Hornhaut und Linse gelegen, mit ~250 µl Kammerwasser gefüllt - gehen etwa 3 Dioptrien Brechkraft verloren.
Im nicht-akkommodierten Zustand (Akkommodationsruhe, Linse abgeflacht, Blick
auf entfernte Gegenstände) hat die Linse etwa 19 Dioptrien
Brechkraft.
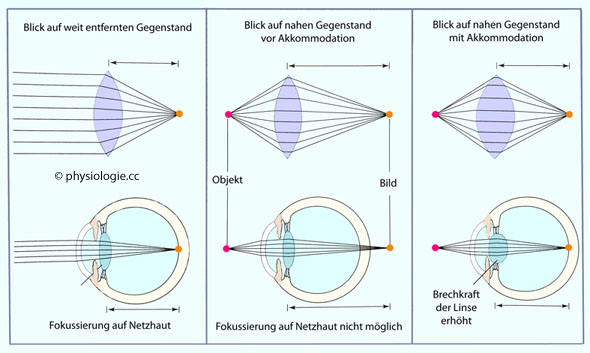
 Abbildung: Anpassung des Auges an die Distanz zum betrachteten Gegenstand
Abbildung: Anpassung des Auges an die Distanz zum betrachteten Gegenstand
Nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Das emmetrope (normalsichtige) Auge bildet weit entfernte Gegenstände scharf auf der Netzhaut ab.
Die Linse hat Eigenelastizität, und
das Zonulasystem passt ihre Krümmung und
damit Refraktionskraft an die Gegenstandsdistanz an, sodass auf der
Netzhaut eine scharfe Abbildung des fixierten Objekts entsteht
Bei Kontraktion des Ziliarmuskels (Nahakkommodation) kann die Brechkraft - in jungen Lebensjahren - bis auf mindestens 30 Dioptrien (um ~12-16 dpt) ansteigen;
sie nähert sich an ihre Eigenform an (soferne sie das noch kann). Nimmt
der Kontraktionsgrad des Ziliarmuskels wieder ab, retrahiert der
Ziliarapparat und flacht die Linse wieder ab (Fernakkommodation).
Akkommodation
erhöht die Brechkraft durch Kontraktion des (hinter der Iris gelegenen)
Ziliarmuskels; dieser wird durch parasympathische Impulse angeregt. Dadurch kann die Brechkraft des Auges um bis zu weitere 15 Dioptrien (Kinder) zunehmen (Altersabhängigkeit s. unten).
 Die Akkommodation nimmt zu, wenn näher am Auge gelegene Gegenstände betrachtet werden (optiko-okulomotorischer
Hirnnervenreflex über Edinger-Westphal-Kern, ggl. ciliare,
Ziliarmuskel) - die
Linse wird dabei entspannt und rundet sich ab, ihre Brechkraft steigt (
Die Akkommodation nimmt zu, wenn näher am Auge gelegene Gegenstände betrachtet werden (optiko-okulomotorischer
Hirnnervenreflex über Edinger-Westphal-Kern, ggl. ciliare,
Ziliarmuskel) - die
Linse wird dabei entspannt und rundet sich ab, ihre Brechkraft steigt ( Abbildung).
Abbildung).
Parasympathische Aktivität kontrahiert den m. ciliaris, die Linse wird entspannt, ihre Brechkraft nimmt zu (Akkommodation)
Parasympatholytika (Atropin) verringern die Akkommodationsbreite
|
Altersabhängigkeit des Akkommodationsvermögens: Das Ausmaß der Zunahme der Brechkraft bei der Akkommodation hängt vom Lebensalter ab: Bei Kindern beträgt sie bis zu 15 Dioptrien, im Pensionsalter nur noch ~1 Dioptrie (Presbyopie  ). Die stärkste Abnahme der
Brechkraft erfolgt im 5. Lebensjahrzehnt.
). Die stärkste Abnahme der
Brechkraft erfolgt im 5. Lebensjahrzehnt.
Häufige Fehlinterpretationen:
1) "Alters-Weitsichtigkeit"
ist ein unsinniger Ausdruck, der daher rührt, dass die mangelnde
Nahakkommodation älterer Menschen durch Plus-Gläser kompensiert werden
kann. Presbyope benötigen Sammellinsen zur Kompensation ihres reduzierten Akkommodationsvermögens, allerdings nur für den Blick auf nahe
Gegenstände ("Lesebrille"). Kurzsichtige ältere Menschen benötigen beim
Blick auf entferntere Gegenstände Minus-Gläser (der Fernpunkt liegt
nahe am Auge).
2) "Kurzsichtigkeit gleicht Alterssichtigkeit aus": Auch dieser Irrglaube beruht auf der Tatsache, dass Myope Minus-Gläser, Presbyope Plus-Gläser benötigen.
Dabei wird vergessen: Myopie ist ein Verrücken des Bereichs scharfer Abbildungen
in die Nähe des Auges (unabhängig vom Akkommodationsvermögen),
Presbyopie hingegen ein reduziertes Akkommodationsvermögen (unabhängig
von der Lage des Fernpunktes).
Wird eine normalsichtige Person
presbyop, braucht sie keine Brille zum Autofahren, weil ja ihr
Fernpunkt nach wie vor im Unendlichen liegt (eine kurzsichtige Person
braucht eine Brille, wegen des nahe am Auge liegendern Fernpunkts) - zum Lesen benötigt die presbyope Person eine Brille (die kurzsichtige kann nahe Gegenstände ohne Brille scharf sehen).
Kurzsichtigkeit bedeutet zu große
Brechkraft des Auges, Alterssichtigkeit reduziertes Akkommodationsvermögen
Myopie
kompensiert keine Presbyopie
|
Fehlsichtigkeit
Bei Visus-Werten <1 (erforderlicher retinaler Mindestabstand größer als 5 µm) ist
das Auflösungsvermögen reduziert - dies kann mehrere Gründe haben:
Reduzierte optische Durchsichtigkeit von Hornhaut, Linse, Glaskörper;
retinale Erkrankungen (Makuladegeneration, retinitis pigmentosa); oder
Refraktionsanomalien:
 Abbildung: Refraktionsanomalien und ihre Korrektur
Nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Abbildung: Refraktionsanomalien und ihre Korrektur
Nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Eine
Veränderung der Bulbuslänge von 1 mm ergibt bereits eine
Fehlsichtigkeit von ~3 Dioptrien. Die gestrichelte Line deutet die
"normale" Position der Netzhaut an


Bei
Weitsichtigkeit (Hypermetropie) ist die Brechkraft des Auges zu gering
(das Auge zu kurz), was durch Kontraktion des Ziliarmuskels ausgeglichen wird
(weitsichtige Kinder klagen oft zuerst über Kopfschmerzen, die mit
andauernder Akkommodation erklärt werden). Der Visus ist normal, der
Blick
auf nahe Gegenstände erschwert.
Weitsichtigkeit wird mit Sammellinsen
(”Plus-Gläsern“) korrigiert; diese wirken wie Lupen.
| Ein
zu kurzes Auge ist hypermetrop. Junge Menschen gleichen das mit
Akkommodation aus, das kann aber Kopfschmerzen verursachen und Schielen
begünstigen
|
 Kurzsichtigkeit
Kurzsichtigkeit
(Myopie

) erniedrigt den Visus, die Brechkraft ist zu hoch (das Auge zu
lang); der Kurzsichtige benötigt zur Korrektur Streulinsen
(”Minus-Gläser“). Diese erkennt man an ihrem verkleinernden Effekt, und
sie sind am Rand dicker als in der Mitte. Meist ist eine Verlängerung des Bulbus die Ursache für eine Myopie.
| Myopie rückt den Fernpunkt nahe an das Auge. Ein "Minusglas" schafft Abhilfe
|

Eine Veränderung der
Bulbuslänge um
einen Millimeter kann durch eine Veränderung der Brechkraft um
drei Dioptrien kompensiert werden (verlängerter Bulbus → Myopie,
verkürzter Bulbus → Hypermetropie).
 Astigmatismus
Astigmatismus

liegt bei ungleicher Brechung in verschiedenen Drehachsen vor. Die
Korrektur erfolgt durch ”Zylinder-Gläser“, die in verschiedenen
Drehachsen unterschiedliche Brechkraft haben - a-stigma: kein Punkt
(Brennpunkt), sondern zwei senkrecht aufeinander stehende Brennlinien -
daher "Stabsichtigkeit".
Pupille und Pupillenreflexe
Die Iris  (Regenbogenhaut) dient
als Lichtblende; sie umrahmt die Öffnung für den Lichtdurchtritt, die
Pupille.
(Regenbogenhaut) dient
als Lichtblende; sie umrahmt die Öffnung für den Lichtdurchtritt, die
Pupille.  Die Pupillenweite beider Augen sollte ident sein (Isokorie
Die Pupillenweite beider Augen sollte ident sein (Isokorie ), bei veränderter Beleuchtungsstärke kommt es zu einer konsensuellen Lichtreaktion. Sind die Pupillen ungleich weit, spricht man von Anisokorie.
), bei veränderter Beleuchtungsstärke kommt es zu einer konsensuellen Lichtreaktion. Sind die Pupillen ungleich weit, spricht man von Anisokorie.

 Abbildung: Merkhilfe
Abbildung: Merkhilfe
Was bedeutet Miosis, was Mydriasis? Merkhilfe: Ein um das
Wort "Miosis" gezogener Kreis ist kleiner (enge Pupille) als ein um das
Wort "Mydriasis" gezogener (weite Pupille)
 Die
Pupillenweite wird durch Muskeln in der Iris eingestellt.
Die
Pupillenweite wird durch Muskeln in der Iris eingestellt.
 Eine Verengerung (Konstriktion) der Pupille (Miosis
Eine Verengerung (Konstriktion) der Pupille (Miosis )
wird durch Kontraktion ringförmig verlaufender, gitternetzartig
angeordneter Fasern des m. sphincter pupillae bewirkt und ist eine parasympathische Funktion (Fasern laufen über den N. oculomotorius), wird also cholinerg angeregt (über M3-Rezeptoren).
)
wird durch Kontraktion ringförmig verlaufender, gitternetzartig
angeordneter Fasern des m. sphincter pupillae bewirkt und ist eine parasympathische Funktion (Fasern laufen über den N. oculomotorius), wird also cholinerg angeregt (über M3-Rezeptoren).
 Eine Erweiterung (Dilatation) der Pupille (Mydriasis
Eine Erweiterung (Dilatation) der Pupille (Mydriasis ) erfolgt durch Kontraktion der radiär angeordneten Fasern des m. dilatator pupillae und ist eine sympathische Funktion (Grenzstrang, Th 1) und wird noradrenerg angeregt (über
) erfolgt durch Kontraktion der radiär angeordneten Fasern des m. dilatator pupillae und ist eine sympathische Funktion (Grenzstrang, Th 1) und wird noradrenerg angeregt (über α
1-Rezeptoren
).
 Merkregel: Ist dir jemand sympathisch, gehen dir die Augen auf (vgl.
Atropineffekt, atropa belladonna: soziales Signal). Aber auch: "Vor
Schreck geweitete Pupille" (Stressreaktion). Oder: Pupillenerweiterung
bei Dunkelheit (gut zu erkennen bei Aufnahmen im Infrarotbereich).
Merkregel: Ist dir jemand sympathisch, gehen dir die Augen auf (vgl.
Atropineffekt, atropa belladonna: soziales Signal). Aber auch: "Vor
Schreck geweitete Pupille" (Stressreaktion). Oder: Pupillenerweiterung
bei Dunkelheit (gut zu erkennen bei Aufnahmen im Infrarotbereich).

 Abbildung: Der sympathische Reflexweg für die Pupillendilatation
Nach einer Vorlage in Berkowitz AL, Clinical Neurology & Neuroanatomy: A Localization-Based Approach, 2nd ed. Mc Graw Hill 2022
Abbildung: Der sympathische Reflexweg für die Pupillendilatation
Nach einer Vorlage in Berkowitz AL, Clinical Neurology & Neuroanatomy: A Localization-Based Approach, 2nd ed. Mc Graw Hill 2022
Der Reflexweg zielt auf eine Pupillenerweiterung (Mydriasis) ab und nutzt drei konsekutive Neuronen vom Hypothalamus bis zur Iris:
Erstes Neuron: Vom Hypothalamus bis zum ziliospinalen Zentrum des oberen Thorakalmarks (im tr. hypothalamicospinalis)
Zweites Neuron: Sympathisch-präganglionär vom ziliospinalen Zentrum bis zum oberen Halsganglion des sympathischen Grenzstrangs
Drittes Neuron: Sympathisch-postganglionär vom oberen Halsganglion bis zum
m. dilatator pupillae (über a. carotis interna und N. trigeminus)
 Der Reflexweg für eine Pupillenerweiterung durchläuft folgende Stationen (
Der Reflexweg für eine Pupillenerweiterung durchläuft folgende Stationen ( Abbildung):
Abbildung):
 1. Neuron im tractus hypothalamicospinalis - vom posterioren Hypothalamus durch den dorsolateralen Hirnstamm - zu sympathisch-präganglionären Neuronen des ziliospinalen Zentrum (Budge's center
1. Neuron im tractus hypothalamicospinalis - vom posterioren Hypothalamus durch den dorsolateralen Hirnstamm - zu sympathisch-präganglionären Neuronen des ziliospinalen Zentrum (Budge's center ) des intermediolateralen Rückenmarks im Bereich C8-Th2.
) des intermediolateralen Rückenmarks im Bereich C8-Th2.
 2.
Neuron (präganglionär) vom ziliospinalen Zentrum über den Bereich der
Lungenspitze zu sympathisch-postganglionären Neuronen im ganglion cervicale superius im Bereich des 2. Halswirbels. Dieses sympathische Ganglion
ist das größte und am weitesten kranial gelegene im Halsbereich. Es stellt die Grundeinstellung der Pupillenweite ein
und wirkt auf die mm. dilatatores
pupillae; bei plötzlich sinkendem Lichtfluss sinkt der
parasympathische, und steigt der sympathische Einfluss auf die Pupille, ihr Durchmesser nimmt zu (Mydriasis).
2.
Neuron (präganglionär) vom ziliospinalen Zentrum über den Bereich der
Lungenspitze zu sympathisch-postganglionären Neuronen im ganglion cervicale superius im Bereich des 2. Halswirbels. Dieses sympathische Ganglion
ist das größte und am weitesten kranial gelegene im Halsbereich. Es stellt die Grundeinstellung der Pupillenweite ein
und wirkt auf die mm. dilatatores
pupillae; bei plötzlich sinkendem Lichtfluss sinkt der
parasympathische, und steigt der sympathische Einfluss auf die Pupille, ihr Durchmesser nimmt zu (Mydriasis).
 3.
Neuron (postganglionär) vom oberen Halsganglion entlang der a. carotis
interna, des sinus cavernosus und des N. ophthalmicus zum Auge; im
Ziliarnerv (gemischt sympathisch / parasympathisch) erreichen autonome
Nervenfasern die vordere Augenpartie.
3.
Neuron (postganglionär) vom oberen Halsganglion entlang der a. carotis
interna, des sinus cavernosus und des N. ophthalmicus zum Auge; im
Ziliarnerv (gemischt sympathisch / parasympathisch) erreichen autonome
Nervenfasern die vordere Augenpartie.
Parasympathische Aktivität kontrahiert den m. sphincter pupillae, die Pupille wird eng (Miosis)
Lokale Hemmung der Cholinesterase steigert die Acetylcholinverfügbarkeit und führt zu Miosis
Sympathische Aktivität kontrahiert den m. dilatator pupillae, die Pupille wird weit (Mydriasis)
|
Der parasympathische Edinger-Westphal-Kern (s. unten) sendet - insbesondere bei Erhöhung der Lichtdichte in der Netzhaut - Impulse an die mm. sphincteres pupillae beider Augen, die Pupille wird enger (Miosis).

 Abbildung: Parasympathischer
Pupillenreflex (bei Erhöhung des Lichtflusses in das Auge) und
Akkommodationsreflex (bei Annäherung des betrachteten Gegenstandes)
Abbildung: Parasympathischer
Pupillenreflex (bei Erhöhung des Lichtflusses in das Auge) und
Akkommodationsreflex (bei Annäherung des betrachteten Gegenstandes)
Nach einer Vorlage bei what-when-how.com/neuroscience
Der parasympathische Pupillenreflex
(links) zielt auf eine Pupillenverengung (Miosis) ab. Er geht der Weg über die prätektale Region (Definition s. unten)
des Mittelhirns, von hier zum
Edinger-Westphal-Kern und (über Fasern des 3. Hirnnerven) zum
Ziliarganglion: Verstärkter Lichteinfall
führt zu Pupillenverengung (rasche Adaptation). Beide prätektalen Kerne
projizieren bilateral gleich intensiv auf die Edinger-Westphal-Kerne,
sodass beide Pupillen gleich stark ("konsensuell") auf Änderungen des
Lichtflusses reagieren.
Der Akkommodationsreflex
(rechts) läuft über die Sehrinde (Annäherung des Betrachtungsobjektes an das
Gesicht), er umfasst einerseits die Miosis wie beim Pupillenreflex,
andererseits auch Kontraktion der medialen Augenmuskeln (mm. recti mediales)
und bewirkt
damit eine Konvergenzbewegung der Augen. Damit bleibt der an das
Gesicht angenäherte betrachtete Gegenstandspunkt auf die foveae beider
Netzhäute projiziert

Der Pupillendurchmesser kann zwischen ~7,5 mm (Maximum) und ~1,5 mm (Minimum) liegen. Das entspricht einem Flächenunterschied um einen Faktor ~25, dem maximalen Bereich einer Veränderung des Lichtflusses in das Auge.
Erhöhung der Lichtstärke löst den Pupillenreflex ( Abbildung) aus. Die Pupillen verengen sich dabei innerhalb einer Sekunde (Latenzzeit 0,2 s) in beiden Augen in gleicher Weise
(konsensuell: Licht in ein Auge - gleiche Pupillenverengung
an beiden Augen). Der Edinger-Westphal-Kern
Abbildung) aus. Die Pupillen verengen sich dabei innerhalb einer Sekunde (Latenzzeit 0,2 s) in beiden Augen in gleicher Weise
(konsensuell: Licht in ein Auge - gleiche Pupillenverengung
an beiden Augen). Der Edinger-Westphal-Kern  sendet efferente Fasern mit dem N. oculomotorius
(III) zum ganglion ciliare in der Orbita, und dieses steuert den m. sphincter pupillae
in der Iris.
sendet efferente Fasern mit dem N. oculomotorius
(III) zum ganglion ciliare in der Orbita, und dieses steuert den m. sphincter pupillae
in der Iris.
Bei gestörter Pupillensteuerung kann die Symmetrie der Pupillenweite wegfallen: Anisokorie  .
.
Die Miose-Komponente ist auch in den Akkommodationsreflex ( Abbildung) integriert, der bei Annäherung eines betrachteten Gegenstandes an das Gesicht
auftritt. Der Reflexweg läuft über die seitlichen Kniehöcker und die
Sehrinde des Okzipitallappens. Das Prätektum schaltet den
Okulomotoriuskern ein; die Konvergenz-Komponente
läuft über den Unterkern, der den m. rectus medialis anregt. Die
Einschaltung des Edinger-Westphal-Kerns erfolgt analog zum
Pupillenreflex.
Abbildung) integriert, der bei Annäherung eines betrachteten Gegenstandes an das Gesicht
auftritt. Der Reflexweg läuft über die seitlichen Kniehöcker und die
Sehrinde des Okzipitallappens. Das Prätektum schaltet den
Okulomotoriuskern ein; die Konvergenz-Komponente
läuft über den Unterkern, der den m. rectus medialis anregt. Die
Einschaltung des Edinger-Westphal-Kerns erfolgt analog zum
Pupillenreflex.
 Das Prätectum (prätektale Region) ist Teil des Epithalamus. Es erhält Afferenzen aus der Netzhaut und grenzt
direkt an die oberen Vierhügel des Mittelhirns. Seine Neuronengruppen
(mindestens 5 Kerne) beteiligen sich an der Steuerung von
Das Prätectum (prätektale Region) ist Teil des Epithalamus. Es erhält Afferenzen aus der Netzhaut und grenzt
direkt an die oberen Vierhügel des Mittelhirns. Seine Neuronengruppen
(mindestens 5 Kerne) beteiligen sich an der Steuerung von
 Pupillenreflexen,
Pupillenreflexen,
 Akkommodation und
Akkommodation und
 physiologischen Nystagmen.
physiologischen Nystagmen.
Pupillenerweiterung (Mydriasis) erfolgt über Aktivität sympathischer Neurone, diese wurzeln im - auf Höhe des
zweiten Halswirbels gelegenen - ganglion cervicale superius
(bei dessen Ausfall verschwindet der sympathische Einfluss auf den
Dilatator, es kommt zu Pupillenverengung). Die Reflexbahn geht vom ziliospinalen Zentrum im Rückenmark (Segmente C8-Th2) aus und wird über den truncus vasosympathicus vermittelt.
Psychologie der Pupillenweite: Mydriasis hat nicht nur optische, sondern auch soziale
Bedeutung (mit weiter Pupille dargestellte Gesichter werden als "sympathischer"
empfunden als ansonsten identische Gesichtsbilder mit enger Pupille). Mydriasis erfolgt unwillkürlich bei positiven Gefühlen
einer betrachteten Person gegenüber (u.a. Freude, sexuelle Erregung) und hat so Signalfunktion (Frauen der höheren Gesellschaft im Römischen Reich
pflegten sich Atropin
in die Augen zu tropfen, um Männern besser zu gefallen -
Tollkirsche = atropa belladonna, bella donna = schöne Frau). Erweiterte
Pupillen erhöhen auch die Vertrauenswürdigkeit, die einer Person unbewusst entgegengebracht
wird. Andererseits kann die Pupillenweite auch bei negativen Gefühlen
wie Ekel, Stress, Erschrecken oder bestimmten Formen der Angst zunehmen. Der gemeinsame Nenner scheint zu sein, dass innere Aufruhr und der Vorgang einer Entscheidungsfindung die Pupillen weiten kann.

Miosis: Bei Ermüdung oder im Schlaf sind die Pupillen verengt.
Ausfall des sympathischen Einflusses führt zum Horner-Syndrom: Miosis + Ptosis (schlaffes Oberlid) + Enophthalmus (leicht eingesunkener Augapfel).
Konvergenzreaktion (near response):
Beim Blick auf einen nahen
Gegenstand treten automatisch folgende Reaktionen auf:
 Konvergenz (die Augen gehen automatisch in "Pseudo-Schielstellung", um die optischen Achsen auf der macula zu halten),
Konvergenz (die Augen gehen automatisch in "Pseudo-Schielstellung", um die optischen Achsen auf der macula zu halten),
 Akkommodation (Naheinstellung) und
Akkommodation (Naheinstellung) und
 Miosis (optischer Vorteil: weniger Randstrahlen).
Miosis (optischer Vorteil: weniger Randstrahlen).
 Über Augenbewegungen s. dort
Über Augenbewegungen s. dort
Akkommodation (Naheinstellung) geht mit Pupillenverengung (Miosis) und Konvergenzbewegung einher
|

Kammerwasser, Augeninnendruck und Tonometrie
Produktion  Zusammensetzung
Zusammensetzung  Abfluss
Abfluss  Augeninnendruck
Augeninnendruck  Tonometrie
Tonometrie
Das Kammerwasser
(aqueous humor) - etwa 250 µl pro Auge (vordere und hintere Augenkammer) - besteht zu 98% aus Wasser.
 Funktionen des Kammerwassers: Mechanische Stützung (Augeninnendruck) sowie Versorgung von Hornhaut und Linse (die über keine Blutgefäße verfügen) mit Nährstoffen, Abtransport von Abbauprodukten.
Kammerwasser wird von den zottenförmigen Fortsätzen des Ziliarkörpers (ciliary body) in die hintere Augenkammer (den Raum hinter der Iris) sezerniert. Die Produktionsrate des Kammerwassers beträgt 2-3 µl/min oder 3-5 ml pro Tag pro Auge) - sein Volumen wird alle 1-2 Stunden vollständig ausgetauscht. 80% der Bildung erfolgt über aktive Sekretion, 15% über Ultrafiltration und 5% über Diffusion. Ein
Austausch (Filtration, Diffusion) erfolgt auch über die Kapillaren der
Netzhaut. Die Produktion des Kammerwassers unterliegt einem zirkadianen
Rhythmus (~3 µl/min morgens, ~1,5 l/min in der Nacht).
Funktionen des Kammerwassers: Mechanische Stützung (Augeninnendruck) sowie Versorgung von Hornhaut und Linse (die über keine Blutgefäße verfügen) mit Nährstoffen, Abtransport von Abbauprodukten.
Kammerwasser wird von den zottenförmigen Fortsätzen des Ziliarkörpers (ciliary body) in die hintere Augenkammer (den Raum hinter der Iris) sezerniert. Die Produktionsrate des Kammerwassers beträgt 2-3 µl/min oder 3-5 ml pro Tag pro Auge) - sein Volumen wird alle 1-2 Stunden vollständig ausgetauscht. 80% der Bildung erfolgt über aktive Sekretion, 15% über Ultrafiltration und 5% über Diffusion. Ein
Austausch (Filtration, Diffusion) erfolgt auch über die Kapillaren der
Netzhaut. Die Produktion des Kammerwassers unterliegt einem zirkadianen
Rhythmus (~3 µl/min morgens, ~1,5 l/min in der Nacht).
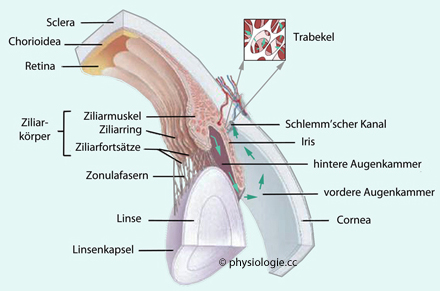
 Abbildung: Bildung und Abfluss des Kammerwassers
Abbildung: Bildung und Abfluss des Kammerwassers
Modifiziert nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Die
Pfeile deuten die Strömung des Kammerwassers an: Produktion durch den
Ziliarkörper in die hintere Augenkammer, zwischen Iris und Linse in die
vordere Augenkammer, von hier durch das Maschenwerk des Kammerwinkels
(Trabekel s. vergrößerter Ausschnitt) und den mit Klappen
ausgestatteten Schlemm'schen Kanal in subsklerale Venen

Als Blut-Kammerwasser-Schranke
wird die Tatsache bezeichnet, dass die Ziliarkapillaren selektive
Permeabilität haben, sie lassen z.B. Immunglobuline nicht in das
Kammerwasser
passieren - wohl aber einige andere Immunkomponenten, wie
antigenpräsentierende Zellen (die das Auge über den Kammerwasserabfluss
verlassen und in den Blutkreislauf gelangen können). Das Auge wird als immunprivilegiertes Organ aufgefasst (Anterior Chamber-Associated Immune Deviation, ACAID):
 Einerseits müssen Infektionen
abgewehrt werden - Ziliarkörper, Iris und Chorioidea enthalten
zahlreiche Immunzellen wie dendritische Zellen, Makrophagen, Mastzellen -,
Einerseits müssen Infektionen
abgewehrt werden - Ziliarkörper, Iris und Chorioidea enthalten
zahlreiche Immunzellen wie dendritische Zellen, Makrophagen, Mastzellen -,
 andererseits soll das Auge nicht durch Entzündungsvorgänge
(irreversibel) geschädigt werden. Dazu verfügt es über ein spezielles
Muster an (vor Entzündungen) schützenden Mechanismen, z.B. exprimieren
Zellen viel Fas-Ligand (FasL), sodass T-Lymphozyten (die über Fas verfügen) einer Apoptose ausgeliefert sind, bevor sie aktiv werden können.
andererseits soll das Auge nicht durch Entzündungsvorgänge
(irreversibel) geschädigt werden. Dazu verfügt es über ein spezielles
Muster an (vor Entzündungen) schützenden Mechanismen, z.B. exprimieren
Zellen viel Fas-Ligand (FasL), sodass T-Lymphozyten (die über Fas verfügen) einer Apoptose ausgeliefert sind, bevor sie aktiv werden können.

Zum Auge als "
immunprivilegiertes Organ" s.
dort
 Elektrolyte (Osmolalität hauptsächlich durch NaCl):
Elektrolyte (Osmolalität hauptsächlich durch NaCl):
Kammerwasser:
Wichtigste Ionenkonzentrationen
|
Na+
|
142 mM
|
K+
|
2,2-4,0 mM
|
Ca++
|
1,8 mM
|
Mg++
|
1,1 mM
|
Cl-
|
132 mM
|
HCO3-
|
20 mM
|
Phosphat
|
0,6 mM
|
 Glucose, Aminosäuren
(Substrat für Energiestoffwechsel, Bausteine für Proteinsynthese:
Posteriore Corneaschichten, trabekuläres Maschenwerk im Kammerwinkel, Linse, anteriore Glaskörperanteile)
Glucose, Aminosäuren
(Substrat für Energiestoffwechsel, Bausteine für Proteinsynthese:
Posteriore Corneaschichten, trabekuläres Maschenwerk im Kammerwinkel, Linse, anteriore Glaskörperanteile)
 Ascorbinsäure (Antioxidans)
Ascorbinsäure (Antioxidans)
 Komponenten des Immunsystems, z.B. Immunglobuline und antigenpräsentierende Zellen
(APC). Gelangt ein Antigen in die vordere Augenkammer, werden dort
befindliche APC aktiviert. Antigene gelangen über den
Kammerwasserabfluss in den Blutkreislauf und zur Milz; Plasmazellen, die nicht-komplementbindende Antikörper produzieren, zytotoxische T-Lymphozyten sowie Zytokine, deren Muster einer Th2-Reaktion entspricht, werden in solchen Fällen aktiviert
Komponenten des Immunsystems, z.B. Immunglobuline und antigenpräsentierende Zellen
(APC). Gelangt ein Antigen in die vordere Augenkammer, werden dort
befindliche APC aktiviert. Antigene gelangen über den
Kammerwasserabfluss in den Blutkreislauf und zur Milz; Plasmazellen, die nicht-komplementbindende Antikörper produzieren, zytotoxische T-Lymphozyten sowie Zytokine, deren Muster einer Th2-Reaktion entspricht, werden in solchen Fällen aktiviert


 Glutathion (GSH) als Redox-Puffer, dient dem Oxidationsschutz
Glutathion (GSH) als Redox-Puffer, dient dem Oxidationsschutz
Die Produktion des Kammerwassers erfordert die Aktivität von Carboanhydrase - diese beschleunigt die Reaktion
CO
2 + H
2O

H
2CO
3
 H+ + HCO3-) bei der Kammerwassersekretion.
H+ + HCO3-) bei der Kammerwassersekretion.
 Folglich reduziert die Gabe von Carboanhydrasehemmern (z.B. Acetazolamid) die Kammerwasserproduktion und senkt somit den Augeninnendruck (s. unten), dessen Höhe ja auf einer Balance von Bildung und Abfluss beruht (Glaukombehandlung).
Folglich reduziert die Gabe von Carboanhydrasehemmern (z.B. Acetazolamid) die Kammerwasserproduktion und senkt somit den Augeninnendruck (s. unten), dessen Höhe ja auf einer Balance von Bildung und Abfluss beruht (Glaukombehandlung).
Carboanhydrase wird zur Bildung des Kammerwassers benötigt
Carboanhydrasehemmer senken den Augeninnendruck
|
Physiologische Widerstände (Strömungswiderstand) für den Abfluss des Kammerwassers sind
der Pupillarwiderstand einerseits (hintere zu vorderer Augenkammer),
der Widerstand an den Austrittspforten aus der vorderen Augenkammer
andererseits (Trabekelwiderstand und uveoskleraler Widerstand):
 Physiologischer Pupillenwiderstand: Sein Betrag schwankt mit dem Öffnungszustand der Linsen-Iris-Barriere. Das in die hintere Augenkammer (Volumen ~50 µl) sezernierte Kammerwasser muss zunächst
den Spaltraum zwischen Linsenvorderfläche und Irisrückfläche passieren,
um in die vordere Augenkammer zu gelangen. Liegt die Iris kontinuierlich ringförmig der Linse an, strömt kein Kammerwasser nach vorne. Erst
wenn der steigende Druck in der hinteren Kammer die Iris von der Linse
abhebt, öffnet sich dieser ventilartige Verschluss und Flüssigkeit
strömt in die vordere Kammer. Die Öffnung erfolgt sporadisch, so wie
die pulsierende Strömung des Kammerwassers in die vordere Augenkammer.
Physiologischer Pupillenwiderstand: Sein Betrag schwankt mit dem Öffnungszustand der Linsen-Iris-Barriere. Das in die hintere Augenkammer (Volumen ~50 µl) sezernierte Kammerwasser muss zunächst
den Spaltraum zwischen Linsenvorderfläche und Irisrückfläche passieren,
um in die vordere Augenkammer zu gelangen. Liegt die Iris kontinuierlich ringförmig der Linse an, strömt kein Kammerwasser nach vorne. Erst
wenn der steigende Druck in der hinteren Kammer die Iris von der Linse
abhebt, öffnet sich dieser ventilartige Verschluss und Flüssigkeit
strömt in die vordere Kammer. Die Öffnung erfolgt sporadisch, so wie
die pulsierende Strömung des Kammerwassers in die vordere Augenkammer.
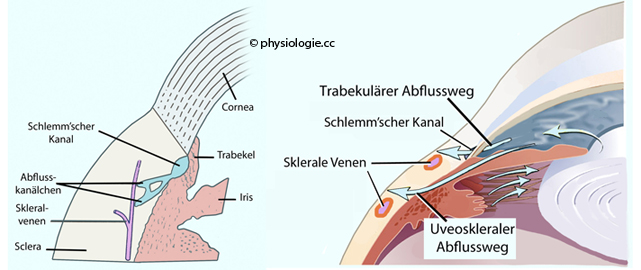
 Abbildung: Abflusswege für das Kammerwasser
Abbildung: Abflusswege für das Kammerwasser
Nach
Vorlagen bei Guyton and Hall, Textbook of Medical Physiology, 15th ed.
Elsevier 2026 (links) und McLaren NC, Moroi SE: Clinical implications
of pharmacogenetics for glaucome therapeutics. The Pharmacogenomics J 2003; 3: 197-201 (rechts)
Links: Kammerwinkel (Iridokornealwinkel) und das System des Abflusses aus der Augenkammer in Venen der Lederhaut. Das Kammerwasser fließt durch das Trabekelwerk in den Schlemm'schen Kanal und von hier über vemöse Abflusskanälchen (aqueous veins) in Venen der Sclera ab (trabekulärer Hauptweg).
Rechts: Kammerwasser
fließt zu etwa einem Zehntel der Gesamtmenge auch durch die Uvea (mittlere Augenhaut) zu venösen Gefäßen der Sclera ab (alternativer uveoskleraler Weg)

 Trabel- und uveoskleraler Widerstand: Aus der vorderen Augenkammer erfolgt der Abfluss des Kammerwassers auf zwei Wegen (
Trabel- und uveoskleraler Widerstand: Aus der vorderen Augenkammer erfolgt der Abfluss des Kammerwassers auf zwei Wegen ( Abbildung):
Abbildung):
 Trabekulär (Hauptweg, "konventionell") über den Schlemm'schen Kanal und über
20-30 radiär liegende Sammelkanäle in episklerale Venen. Auf diesem Weg
verlassen 80-95% des Kammerwassers die vordere Kammer, der Betrag ist
druckabhängig. Der
Schlemm'sche Kanal verfügt über Klappen, was die Strömung der Flüssigkeit in Richtung Venen sicherstellt.
Trabekulär (Hauptweg, "konventionell") über den Schlemm'schen Kanal und über
20-30 radiär liegende Sammelkanäle in episklerale Venen. Auf diesem Weg
verlassen 80-95% des Kammerwassers die vordere Kammer, der Betrag ist
druckabhängig. Der
Schlemm'sche Kanal verfügt über Klappen, was die Strömung der Flüssigkeit in Richtung Venen sicherstellt.
 Uveoskleral (alternativ, "unkonventionell"): 5-20% des
Kammerwasserabflusses in venöse Gefäße der Lederhaut. Dieser Weg kann
bei mangelhaftem Abfluss durch den Hauptweg (Glaukom) an Bedeutung
gewinnen.
Uveoskleral (alternativ, "unkonventionell"): 5-20% des
Kammerwasserabflusses in venöse Gefäße der Lederhaut. Dieser Weg kann
bei mangelhaftem Abfluss durch den Hauptweg (Glaukom) an Bedeutung
gewinnen.
Kammerwasser wird zum Großteil über den Schlemm´schen Kanal
in subsklerale Venen (unter
der Bindehaut) abgeleitet - ein kleinerer Teil verlässt die hintere
Augenkammer über Poren in der Sklera und mündet in Lymphgefäße.
Das Gleichgewicht von Bildung und Abfluss des
Kammerwassers ist für die Erhaltung des Augeninnendrucks (IOP: intraocular pressure)
entscheidend. Dieser Druck unterstützt die Formkonstanz des Auges und
beträgt etwa 2
kPa (15 mm Hg). Er ist abhängig von Körperlage (niedriger im Stehen oder Sitzen, höher im Liegen, besonders in Bauchlage: ~20 mmHg) und
Tageszeit (teilweise durch die
Körperposition beeinflusst).
Der Augeninnendruck
ergibt sich aus der Produktion von Kammerwasser einerseits, dem
Abflusswiderstand aus dem Auge andererseits (ähnlich der Dynamik
Herzzeitvolumen / peripherer Gefäßwiderstand, vgl. Blutdruck). Er wirkt sich auch auf
die Durchblutung der Netzhaut aus und ist eine wichtige klinische
Messgröße.
 Augeninnendruck
Augeninnendruck (sitzende Position)
2 + 0,4
kPa (15 + 3 mm Hg)
Abhängig von der Körperlage
(höher im Liegen,
besonders in Bauchlage: bis ca. 20 mmHg)
Erhöhungen des intraokulären Drucks verringern den Durchmesser intraokulärer Gefäße (sie reduzieren den transmuralen Druck)
und erhöhen den Strömungswiderstand, was die retinale Perfusion
reduziert.
Dynamik des Kammerwasserabflusses:
Der Augeninnendruck ändert sich ständig, z.B. mit Augenbewegungen, beim
Blinzeln, mit dem arteriellen Puls, mit der Körperlage
(im Liegen höher als im Sitzen oder Stehen); das beeinflusst
Augeninnendruck und Augenform, Fließwiderstand und Abfluss des
Kammerwassers. Anhaltende Erhöhungen des
Augeninnendrucks werden durch Umlagerungen im extrazellulären
Maschenwerk des Kammerwinkels mit Erniedrigung des Abflusswiderstandes
beantwortet - auf diese Weise wird Druckerhöhungen im Auge regulativ
entgegengewirkt.
Mydriasis erschwert den Kammerwasserabfluss. Mydriatika sind bei Glaukompatienten kontraindiziert
|

 Abbildung: Augeninnendruck bei zunehmendem Volumen
Abbildung: Augeninnendruck bei zunehmendem Volumen
Nach Detorakis ET, Pallikaris IT. Ocular rigidity: biomechanical role, in vivo measurements and clinical significance. Clin Exp Ophthalmol 2013; 41: 73-81
In-vivo-Modell. Die blaue Kurve extrapoliert die Messpunkte.
Wie bei anderen Hohlorganen auch, nimmt der Druck mit steigendem Volumen nichtlinear zu (die Volumencompliance nichtlinear ab)

Die Volumencompliance
des menschlichen Auges beträgt (bei normaler Rigidität) im niedrigen
Druckbereich vermutlich etwa 4 µl/mmHg und nimmt bei sehr hohen Drucken
(über 60 mmHg) auf die Hälfte dieses Betrages ab ( Abbildung). Das
Volumen der flüssigkeitsgefüllten Räume (vordere plus hintere
Augenkammer) beträgt 0,2 bis 0,4 ml.
Abbildung). Das
Volumen der flüssigkeitsgefüllten Räume (vordere plus hintere
Augenkammer) beträgt 0,2 bis 0,4 ml.
Tageszeit und zirkadiane Rhythmen:
Mehrere Zustandsvariablen des Auges ändern sich mit der Tageszeit
(Augeninnendruck, Dicke und Form der Hornhaut, Ausmaße der vorderen
Augenkammer); bei entsprechender
Indikation ist ein Tagesprofil zu
erheben. Diese Schwankungen scheinen für Wachstum und
Anpassungsfähigkeit des Auges bedeutsam zu sein. Innendruck und Länge
des Augapfels sind beim Menschen (bei genormter Körperlage) tagsüber,
die Dicke der Chorioidea nachts am höchsten.
Die dem allgemeinen Strömungsgesetz analoge Formulierung wird als Goldmann-Gleichung bezeichnet: Statt Strömung = Druckdifferenz / Widerstand heisst es hier
wobei IOP = intraokularer Druck ("p1", ~15 mmHg), Pv
= episkleraler venöser Druck ("p2", 7-14 mmHg), F = Bildungsrate des Kammerwassers
(analog "Strömung"), und R = Abflusswiderstand im Kammerwinkel (etwa 3-4 mmHg/µl.min).
Der venöse Druck steigt bei Wechsel von aufrechter zu Rückenlage um 3-4
mmHg, auch der Augeninnendruck nimmt bei einem solchen Lagewechsel
etwas zu. Ursache ist der hydrostatische Druckanstieg im Kopfbereich, der sich nicht nur in den Blugefäßen, sondern auch anderen flüssigkeitsgefüllten Räumen auswirkt.
Unphysiologisch hohe Werte bei einem Glaukom führen durch retinale Mangeldurchblutung zu Skotomen.
Geräte zur
Messung des Augeninnendrucks heißen Tonometer.
 Fast alle Messungen des Augeninnendrucks erfolgen in der Praxis
nichtinvasiv, d.h. der Druck wird nicht direkt im Auge gemessen,
sondern aus Verformung der Hornhaut bei Druckausübung auf das Auge -
unter Berührung des Messsystems (Impression, Applanation) oder
berührungsfrei (z.B. mittels Luftstoß) - ermittelt. Solche indirekten
Methoden sind naturgemäß fehleranfällig, haben sich aber in der Praxis
bewährt und erzielen hinlängliche Präzision.
Fast alle Messungen des Augeninnendrucks erfolgen in der Praxis
nichtinvasiv, d.h. der Druck wird nicht direkt im Auge gemessen,
sondern aus Verformung der Hornhaut bei Druckausübung auf das Auge -
unter Berührung des Messsystems (Impression, Applanation) oder
berührungsfrei (z.B. mittels Luftstoß) - ermittelt. Solche indirekten
Methoden sind naturgemäß fehleranfällig, haben sich aber in der Praxis
bewährt und erzielen hinlängliche Präzision.
 Bei der (klassischen) Impressionstonometrie nach
Schiötz wird das Tonometer bei
liegenden Personen auf das Auge gesetzt und die (druckabhängige) Eindringtiefe eines Messstiftes ermittelt (bei abnormer Rigidität des Augapfels können falsche Werte resultieren).
Bei der (klassischen) Impressionstonometrie nach
Schiötz wird das Tonometer bei
liegenden Personen auf das Auge gesetzt und die (druckabhängige) Eindringtiefe eines Messstiftes ermittelt (bei abnormer Rigidität des Augapfels können falsche Werte resultieren).
 Eine Applanationstonometrie (
Eine Applanationstonometrie (  Abbildung) erfolgt an sitzenden
Personen. Nach Gabe fluoreszierender
Augentropfen wird die (druckabhängige) Größe der Abplattungsfläche bei
Ausübung eines Druckes auf das Auge unter UV-Licht ermittelt.
Abbildung) erfolgt an sitzenden
Personen. Nach Gabe fluoreszierender
Augentropfen wird die (druckabhängige) Größe der Abplattungsfläche bei
Ausübung eines Druckes auf das Auge unter UV-Licht ermittelt.


Abbildung: Applanationstonometrie
Nach einer Vorlage in one.aao.org
Der
Meßkopf übt auf den Augapfel einen adjustierbaren Druck aus, dadurch
ergibt sich eine Auflagefläche, die mit wachsendem Augeninnendruck
immer kleiner wird

 Will man einen direkten Kontekt mit der Hornhaut meiden, kann man den
intraokularen Druck durch das Lid hindurch am geschlossenen Auge
mittels transpalpebraler skleraler
Tonometrie bestimmen - mittels mechanischem Sensor in liegender oder
sitzender Körperposition mit um 45° nach oben gerichtetem Auge.
Will man einen direkten Kontekt mit der Hornhaut meiden, kann man den
intraokularen Druck durch das Lid hindurch am geschlossenen Auge
mittels transpalpebraler skleraler
Tonometrie bestimmen - mittels mechanischem Sensor in liegender oder
sitzender Körperposition mit um 45° nach oben gerichtetem Auge.
 Mit der Dynamic Contour-Tonometrie (DCT)
wird der Augeninnendruck mittels in den Tonometerkopf eingebautem
Drucksensor gemessen, der Druck zwischen Sensor und Hornhaut entspricht
dem intraokularen Druck. Bei dieser Methode wird die Hornhaut nur
leicht abgeflacht und behält weitgehend ihre dynamische Verformbarkeit. So können auch Pulskurven des Augeninnendrucks
registriert werden.
Mit der Dynamic Contour-Tonometrie (DCT)
wird der Augeninnendruck mittels in den Tonometerkopf eingebautem
Drucksensor gemessen, der Druck zwischen Sensor und Hornhaut entspricht
dem intraokularen Druck. Bei dieser Methode wird die Hornhaut nur
leicht abgeflacht und behält weitgehend ihre dynamische Verformbarkeit. So können auch Pulskurven des Augeninnendrucks
registriert werden.
 Weitgehender Standard in der Ordination ist die (wenn auch etwas
weniger genaue) berührungsfreie Messung der durch einen Luft-Jet verursachten Verformung der Hornhaut (Non-Contact-, air puff- Tonometrie, NCT,
Weitgehender Standard in der Ordination ist die (wenn auch etwas
weniger genaue) berührungsfreie Messung der durch einen Luft-Jet verursachten Verformung der Hornhaut (Non-Contact-, air puff- Tonometrie, NCT,  Abbildung). Diese Methode wird nicht nur von
medizinischem Personal, sondern zusehends auch von Augenoptikern angewendet.
Abbildung). Diese Methode wird nicht nur von
medizinischem Personal, sondern zusehends auch von Augenoptikern angewendet.

Abbildung: Berührungsfreie Tonometrie (NCT)
Nach Lim TC, Chattopadhyay S, Acharya UR: A survey and comparative study on the instruments for glaucoma detection. Med Eng Phys 2012; 34: 129-39
Ein Luftstoß flacht die Hornhaut ab - je niedriger der
Augeneninnendruck, desto mehr gibt die Hornhaut nach. Ein an der
Hornhaut reflektierter Lichtstrahl ändert sich entsprechend, was vom
Detektor registriert wird

 Eine ungenaue Schätzung des
Augeninnendrucks
kann auch mittels Palpation erfolgen (orientierende Erstuntersuchung):
Die untersuchte Person schließt die Augen, zwei Finger drücken
abwechselnd auf den Augapfel, der Druck wird über die Verformbarkeit des Augapfels eingestuft (weich? hart?).
Eine ungenaue Schätzung des
Augeninnendrucks
kann auch mittels Palpation erfolgen (orientierende Erstuntersuchung):
Die untersuchte Person schließt die Augen, zwei Finger drücken
abwechselnd auf den Augapfel, der Druck wird über die Verformbarkeit des Augapfels eingestuft (weich? hart?).
Umweltreize wie UV-Licht, Ozon, Abgase, Zigarettenrauch, Klimatisierung und lang andauernde Computerarbeit belasten die Epithelzellen auf Binde- und Hornhaut und tragen zur Austrocknung des Auges bei (Sicca- bzw. Sjögren-Syndrom). Weiters nimmt die Produktion an Tränenflüssigkeit mit zunehmendem Alter ab.
Der Schirmer-Test  schätzt die
Tränenproduktion ab: Ein Papierstreifen (25 x 5 mm) wird in den
Bindehautsack placiert; nach 5 Minuten sollte eine 15 mm lange
Befeuchtungszone auftreten (basale Sekretion).
schätzt die
Tränenproduktion ab: Ein Papierstreifen (25 x 5 mm) wird in den
Bindehautsack placiert; nach 5 Minuten sollte eine 15 mm lange
Befeuchtungszone auftreten (basale Sekretion).
 Katarakt
Katarakt  (grauer Star: Linsentrübung meist unbekannter Ursache, oft im Alter auftretend) ist weltweit die häufigste Erblindungsursache.
Die operative Linsenentfernung mit Ersatz durch eine Kunststofflinse
behebt die Sichtstörung und ist eine der am häufigsten durchgeführten
Operationen (s. oben).
(grauer Star: Linsentrübung meist unbekannter Ursache, oft im Alter auftretend) ist weltweit die häufigste Erblindungsursache.
Die operative Linsenentfernung mit Ersatz durch eine Kunststofflinse
behebt die Sichtstörung und ist eine der am häufigsten durchgeführten
Operationen (s. oben).
 Bei Menschen über 50 Jahren ist eine Erblindung häufig durch altersabhängige Makuladegeneration bedingt. Bei 4/5 der Fälle liegt eine trockene Form
vor, bei der es zu Ablagerungen von Lipiden und anderen
Stoffwechselendprodukten unter das Pigmentepithel kommt, das dadurch
degeneriert. Dieser Zustand kann in eine feuchte Form übergehen, bei der es zum Einwachsen von Gefäßen und Ödembildung kommt.
Bei Menschen über 50 Jahren ist eine Erblindung häufig durch altersabhängige Makuladegeneration bedingt. Bei 4/5 der Fälle liegt eine trockene Form
vor, bei der es zu Ablagerungen von Lipiden und anderen
Stoffwechselendprodukten unter das Pigmentepithel kommt, das dadurch
degeneriert. Dieser Zustand kann in eine feuchte Form übergehen, bei der es zum Einwachsen von Gefäßen und Ödembildung kommt.
 Behinderung des
Abflusses von Kammerwasser erhöht den Druck über den physiologischen Grenzwert von ~3 kPa (Glaukom
Behinderung des
Abflusses von Kammerwasser erhöht den Druck über den physiologischen Grenzwert von ~3 kPa (Glaukom  ,
grüner Star) und
gefährdet Netzhautdurchblutung und Sehnerven. Farb-Fehlwahrnehmungen
und Ausfälle im Gesichtsfeld (Skotome) - zunächst in der
Netzhautperipherie (~20°) - sind die Folge.
,
grüner Star) und
gefährdet Netzhautdurchblutung und Sehnerven. Farb-Fehlwahrnehmungen
und Ausfälle im Gesichtsfeld (Skotome) - zunächst in der
Netzhautperipherie (~20°) - sind die Folge.
Offenwinkelglaukom:
Dies ist die häufigere Glaukomform, sie wird oft erst sehr spät
entdeckt. Der Kammerwasserabfluss ist bei dieser Glaukomform im Bereich
des Schlemm'schen Kanals

behindert.
Engwinkelglaukom ensteht bei einem Abflusshindernis zwischen Hornhaut und Iris. Der
Kammerwasserabfluss ist bei
dieser Form durch Pupillenverengung (Miosis) erleichtert, bei
Pupillenerweiterung (Mydriasis) erschwert; die Patienten erhalten daher
pupillenverengende Mittel (Miotika).
Kunstfehler: Die sonst beim Augenspiegeln
routinemäßig erfolgende Pupillenerweiterung durch Eintropfen eines
Mydriatikums ist hier streng verboten, da sonst ein Anstieg des
Augeninnendrucks die Durchblutung behindert und das Auge akut gefährdet.
 Parasympathimimetika regen den Ziliarmuskel zur Kontraktion an, erleichtern den Kammerwasserabfluss und senken den Augeninnendruck,
Parasympathimimetika regen den Ziliarmuskel zur Kontraktion an, erleichtern den Kammerwasserabfluss und senken den Augeninnendruck,  vgl. dort
vgl. dort


 Die Hornhaut ist das am stärksten lichtbrechende Medium des
dioptrischen Apparates (~43 dpt). Sie besteht aus Epithelschicht (~50
µm), Bowman-Membran (~10 µm), Stroma (~0,5 mm), Descemet-Membran (~10
µm) und Endothelzellschicht (~5 µm). Optimale Transparenz ergibt sich
bei einem Stromadruck von -40 mmHg (Unterdruck), der durch
Ionentransport aus der Hornhaut (zu Tränenflüssigkeit bzw.
Kammerwasser) entsteht
Die Hornhaut ist das am stärksten lichtbrechende Medium des
dioptrischen Apparates (~43 dpt). Sie besteht aus Epithelschicht (~50
µm), Bowman-Membran (~10 µm), Stroma (~0,5 mm), Descemet-Membran (~10
µm) und Endothelzellschicht (~5 µm). Optimale Transparenz ergibt sich
bei einem Stromadruck von -40 mmHg (Unterdruck), der durch
Ionentransport aus der Hornhaut (zu Tränenflüssigkeit bzw.
Kammerwasser) entsteht
 Auf der Hornhaut liegt ein dreischichtiger Flüssigkeitsfilm:
Tränenflüssigkeit (3-4 µ), Schleimschicht (1 µ) und Fettfilm (0,2 µ) -
darüber ein von Tarsaldrüsen (Meibom-Drüsen) produzierter öliger Film.
Tränenflüssigkeit enthält Nährstoffe, Enzyme, Immunglobuline, und ist
durchlässig für Sauerstoff. Sie wird über die Tränenwege - punctua
lacrimalia, ductus lacrimales superior und inferior, saccus lacrimalis,
ductus nasolacrimalis - in die Nase abtransportiert Auf der Hornhaut liegt ein dreischichtiger Flüssigkeitsfilm:
Tränenflüssigkeit (3-4 µ), Schleimschicht (1 µ) und Fettfilm (0,2 µ) -
darüber ein von Tarsaldrüsen (Meibom-Drüsen) produzierter öliger Film.
Tränenflüssigkeit enthält Nährstoffe, Enzyme, Immunglobuline, und ist
durchlässig für Sauerstoff. Sie wird über die Tränenwege - punctua
lacrimalia, ductus lacrimales superior und inferior, saccus lacrimalis,
ductus nasolacrimalis - in die Nase abtransportiert
 Die basale Sekretion von Tränenflüssigkeit feuchtet das Auge an,
schützt und versorgt es mit Nähr- und Wirkstoffen: Salze (9 g/l NaCl), Glucose (Epithelversorgung), Aminosäuren,
Harnstoff; Mucin (Viskosität ~1,3 cP), Lipide (hydrophobe
Schutzschicht), Hormone (Prolaktin, Enkephalin, ACTH) und
Immunsubstanzen (sIgA, Lysozym, Laktoferrin, Lipocaline). Reflektorisch
angeregte Sekretion (muskarinisch-parasympathisch) spült Irritantien
fort. Tränenflüssigkeit ist fast plasmaisoton (~320 mOsm/kg) und
hat einen pH-Wert von 7,4 (wie Blut)
Die basale Sekretion von Tränenflüssigkeit feuchtet das Auge an,
schützt und versorgt es mit Nähr- und Wirkstoffen: Salze (9 g/l NaCl), Glucose (Epithelversorgung), Aminosäuren,
Harnstoff; Mucin (Viskosität ~1,3 cP), Lipide (hydrophobe
Schutzschicht), Hormone (Prolaktin, Enkephalin, ACTH) und
Immunsubstanzen (sIgA, Lysozym, Laktoferrin, Lipocaline). Reflektorisch
angeregte Sekretion (muskarinisch-parasympathisch) spült Irritantien
fort. Tränenflüssigkeit ist fast plasmaisoton (~320 mOsm/kg) und
hat einen pH-Wert von 7,4 (wie Blut)
 Die Dioptrie (dpt) ist der Kehrwert einer in Meter angegebenen Strecke,
hier der Brennweite. Je größer die Dioptrienzahl, desto höher das
Refraktionsvermögen: Hornhaut 43 dpt, Linse 19 dpt, Auge als
zusammengesetztes System 59 dpt. Der Brechungsindex n
eines optischen Mediums ist ein Maß für die Geschwindigkeit, mit der
das Licht durch das Medium wandert: n = Lichtgeschwindigkeit im Vakuum
/ Lichtgeschwindigkeit im Medium. Wasser (1,33) bzw. Tränenflüssigkeit
(1,34) hat einen höheren Brechungsindex als Luft (1,0).
Die Dioptrie (dpt) ist der Kehrwert einer in Meter angegebenen Strecke,
hier der Brennweite. Je größer die Dioptrienzahl, desto höher das
Refraktionsvermögen: Hornhaut 43 dpt, Linse 19 dpt, Auge als
zusammengesetztes System 59 dpt. Der Brechungsindex n
eines optischen Mediums ist ein Maß für die Geschwindigkeit, mit der
das Licht durch das Medium wandert: n = Lichtgeschwindigkeit im Vakuum
/ Lichtgeschwindigkeit im Medium. Wasser (1,33) bzw. Tränenflüssigkeit
(1,34) hat einen höheren Brechungsindex als Luft (1,0).
 Abbildungsfehler: Kurzwelliges Licht (blau) wird stärker gebrochen als langwelliges (rot), Randstrahlen zeigen chromatische Aberration (Farbsäume), die sich im Auge kaum bemerkbar macht. Sphärische Aberration (Hyperopie, Myopie) und Astigmatismus können optisch korrigiert werden Abbildungsfehler: Kurzwelliges Licht (blau) wird stärker gebrochen als langwelliges (rot), Randstrahlen zeigen chromatische Aberration (Farbsäume), die sich im Auge kaum bemerkbar macht. Sphärische Aberration (Hyperopie, Myopie) und Astigmatismus können optisch korrigiert werden
 Ohne Akkommodation vereint das normalsichtige Auge parallel
eintreffende Lichtstrahlen auf der Netzhaut zu einem Punkt. Von nahe am
Auge liegenden Gegenstandspunkten divergieren die Lichtstrahlen;
Erhöhung der Brechkraft (Linse) ermöglicht ihre Bündelung auf der
Netzhaut zu einem Bildpunkt. Die höchstmögliche Änderung der Brechkraft
des Auges wird als Akkommodationsbreite bezeichnet, aus 1/N - 1/F
berechnet und in dptr angegeben
Ohne Akkommodation vereint das normalsichtige Auge parallel
eintreffende Lichtstrahlen auf der Netzhaut zu einem Punkt. Von nahe am
Auge liegenden Gegenstandspunkten divergieren die Lichtstrahlen;
Erhöhung der Brechkraft (Linse) ermöglicht ihre Bündelung auf der
Netzhaut zu einem Bildpunkt. Die höchstmögliche Änderung der Brechkraft
des Auges wird als Akkommodationsbreite bezeichnet, aus 1/N - 1/F
berechnet und in dptr angegeben
 Retinales Auflösungsvermögen: Ein Bogengrad entspricht auf der Netzhaut
300 µm Abstand. In der fovea centralis sind die Zapfen am dichtesten
gepackt - Abstand kaum 3 µm - und sie sind zu ihren Ganglienzellen 1:1
verschaltet. Sind zwei Zapfen durch einen weiteren getrennt, entspricht
das einem Abstand auf der Netzhaut von ~5 µm, entsprechend einer
Bogenminute. Der Visus (Maß für das Auflösungsvermögen) kann als
Quotient Ist-Abstand (von einer Sehprobentafel) / Soll-Abstand bestimmt
werden
Retinales Auflösungsvermögen: Ein Bogengrad entspricht auf der Netzhaut
300 µm Abstand. In der fovea centralis sind die Zapfen am dichtesten
gepackt - Abstand kaum 3 µm - und sie sind zu ihren Ganglienzellen 1:1
verschaltet. Sind zwei Zapfen durch einen weiteren getrennt, entspricht
das einem Abstand auf der Netzhaut von ~5 µm, entsprechend einer
Bogenminute. Der Visus (Maß für das Auflösungsvermögen) kann als
Quotient Ist-Abstand (von einer Sehprobentafel) / Soll-Abstand bestimmt
werden
 Weitsichtigkeit (Hypermetropie) ist zu geringe Brechkraft des Auges
(Auge zu kurz) und wird mit Sammellinsen (”Plus-Gläsern“) korrigiert;
Kurzsichtigkeit (Myopie) ist zu hohe Brechkraft (Auge zu lang,
Fernpunkt nahe am Auge) und wird mit Zerstreuungslinsen
("Minus-Gläsern“) korrigiert. Junge Menschen gleichen Myopie mit
Akkommodation aus, was Kopfschmerzen verursachen und Schielen
begünstigen kann. Stabsichtigkeit (Astigmatismus) bedeutet ungleiche
Refraktion in den Drehachsen und wird mit Linsen entgegengesetzter
optischer Ungleichheit (”Zylinder-Gläsern“) korrigiert
Weitsichtigkeit (Hypermetropie) ist zu geringe Brechkraft des Auges
(Auge zu kurz) und wird mit Sammellinsen (”Plus-Gläsern“) korrigiert;
Kurzsichtigkeit (Myopie) ist zu hohe Brechkraft (Auge zu lang,
Fernpunkt nahe am Auge) und wird mit Zerstreuungslinsen
("Minus-Gläsern“) korrigiert. Junge Menschen gleichen Myopie mit
Akkommodation aus, was Kopfschmerzen verursachen und Schielen
begünstigen kann. Stabsichtigkeit (Astigmatismus) bedeutet ungleiche
Refraktion in den Drehachsen und wird mit Linsen entgegengesetzter
optischer Ungleichheit (”Zylinder-Gläsern“) korrigiert
 Die Linse hat 19 dpt Brechkraft (bei Akkommodation mehr). Ein
linsenloses (aphakes) Auge kann keine scharfen Bilder erzeugen.
Akkommodation erhöht die Brechkraft durch (parasympathisch ausgelöste)
Kontraktion des Ziliarmuskels, bei Kindern um bis zu weitere 15
Dioptrien. Akkommodation tritt bei Blick auf nahe Gegenstände auf
(optiko-okulomotorischer Hirnnervenreflex) - die Linse wird entspannt,
nimmt ihre kugelige Eigenform an, ihre Brechkraft steigt. Blick auf
nahe Gegenstände löst Akkommodation, Miosis und Konvergenzbewegung aus.
Alterssichtigkeit (Presbyopie) bedeutet reduziertes
Akkommodationsvermögen
Die Linse hat 19 dpt Brechkraft (bei Akkommodation mehr). Ein
linsenloses (aphakes) Auge kann keine scharfen Bilder erzeugen.
Akkommodation erhöht die Brechkraft durch (parasympathisch ausgelöste)
Kontraktion des Ziliarmuskels, bei Kindern um bis zu weitere 15
Dioptrien. Akkommodation tritt bei Blick auf nahe Gegenstände auf
(optiko-okulomotorischer Hirnnervenreflex) - die Linse wird entspannt,
nimmt ihre kugelige Eigenform an, ihre Brechkraft steigt. Blick auf
nahe Gegenstände löst Akkommodation, Miosis und Konvergenzbewegung aus.
Alterssichtigkeit (Presbyopie) bedeutet reduziertes
Akkommodationsvermögen
 Der Pupillendurchmesser beträgt zwischen 1,5 (Miosis) und 7,5 mm
(Mydriasis) - ein ~25-facher Flächenunterschied. Acetylcholin bewirkt
Miosis (Cholinesterasehemmer verengen die Pupille), Katecholamine
(Sympathikus) erweitern sie. Wird es heller, tritt (beidseitig:
konsensuell) der Pupillenreflex auf: Edinger-Westphal-Kern → N.
oculomotorius → ganglion ciliare → m. sphincter pupillae in der Iris.
Miose ist auch Teil des Akkommodationsreflexes (corpus geniculatum
laterale → Sehrinde des Okzipitallappens → Prätektum →
Edinger-Westphal-Kern). Mydriasis wird sympathisch angeregt
(ziliospinales Zentrum C8-Th2) → truncus vasosympathicus → Kontraktion
des m. dilatator pupillae
Der Pupillendurchmesser beträgt zwischen 1,5 (Miosis) und 7,5 mm
(Mydriasis) - ein ~25-facher Flächenunterschied. Acetylcholin bewirkt
Miosis (Cholinesterasehemmer verengen die Pupille), Katecholamine
(Sympathikus) erweitern sie. Wird es heller, tritt (beidseitig:
konsensuell) der Pupillenreflex auf: Edinger-Westphal-Kern → N.
oculomotorius → ganglion ciliare → m. sphincter pupillae in der Iris.
Miose ist auch Teil des Akkommodationsreflexes (corpus geniculatum
laterale → Sehrinde des Okzipitallappens → Prätektum →
Edinger-Westphal-Kern). Mydriasis wird sympathisch angeregt
(ziliospinales Zentrum C8-Th2) → truncus vasosympathicus → Kontraktion
des m. dilatator pupillae
 Der Ziliarkörper bildet Kammerwasser; dazu wird Carboanhydrase
benötigt. Carboanhydrasehemmer senken den Augeninnendruck. Der Abfluss
des Kammerwassers erfolgt von der rückwärtigen zur vorderen Augenkammer
(physiologischer Pupillenwiderstand) und von dort trabekulär über den
Schlemm'schen Kanal und Sammelkanäle in episklerale Venen (80-95%)
sowie
Der Ziliarkörper bildet Kammerwasser; dazu wird Carboanhydrase
benötigt. Carboanhydrasehemmer senken den Augeninnendruck. Der Abfluss
des Kammerwassers erfolgt von der rückwärtigen zur vorderen Augenkammer
(physiologischer Pupillenwiderstand) und von dort trabekulär über den
Schlemm'schen Kanal und Sammelkanäle in episklerale Venen (80-95%)
sowie
uveoskleral in andere Venen (5-20% des Kammerwasserabflusses). Die Balance Bildung / Abfluss bestimmt den Augeninnendruck (~2 kPa); dieser wird über Tonometer gemessen (Impression, Applanation, kontaktfrei)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Hornhaut
Hornhaut  Tränensystem
Tränensystem  Visusbestimmung
Visusbestimmung  Linse
Linse  Akkommodation
Akkommodation  Fehlsichtigkeiten
Fehlsichtigkeiten  Pupille, Miosis, Mydriasis
Pupille, Miosis, Mydriasis  Kammerasser & Augeninnendruck
Kammerasser & Augeninnendruck
 Dioptrie
Dioptrie  Prätectum
Prätectum
 Core messages
Core messages Sehen, Gesicht (idg.) *seku (sehen, mit den Augen folgen)
Sehen, Gesicht (idg.) *seku (sehen, mit den Augen folgen) Augenmuskeln
Augenmuskeln
 Abbildung: Tränenwege
Abbildung: Tränenwege
 - sinkt der Augapfel ein wenig in die Augenhöhle zurück (Enophthalmus).
- sinkt der Augapfel ein wenig in die Augenhöhle zurück (Enophthalmus). einen dioptrischen
einen dioptrischen  Apparat - Hornhaut (cornea), Linse (lens),
Glaskörper (corpus vitreum) - für Lichtbrechung, Lichtleitung, Bildentstehung,
Apparat - Hornhaut (cornea), Linse (lens),
Glaskörper (corpus vitreum) - für Lichtbrechung, Lichtleitung, Bildentstehung,  Sinnes-und Nervenzellen in
der Netzhaut zur Aufnahme, Verarbeitung und Leitung optischer
Information, sowie
Sinnes-und Nervenzellen in
der Netzhaut zur Aufnahme, Verarbeitung und Leitung optischer
Information, sowie  einen Hilfsapparat.
einen Hilfsapparat. ) des Oberlids führt.
) des Oberlids führt.
 Abbildung: Augenlid und Bindehaut
Abbildung: Augenlid und Bindehaut

 Meibom-sche Drüsen
Meibom-sche Drüsen  (Tarsal-, Talgdrüsen), die am Innenrand der Lider eine ölige Flüssigkeit (>Abbildung unten) sezernieren;
(Tarsal-, Talgdrüsen), die am Innenrand der Lider eine ölige Flüssigkeit (>Abbildung unten) sezernieren;  Moll-sche Drüsen
Moll-sche Drüsen  (gll. ciliares conjunctivales,
Wimperndrüsen), apokrine Schweißdrüsen, die zwischen den beiden anderen
Ausführungsgängen münden; und
(gll. ciliares conjunctivales,
Wimperndrüsen), apokrine Schweißdrüsen, die zwischen den beiden anderen
Ausführungsgängen münden; und  Zeis-sche Drüsen
Zeis-sche Drüsen  , Talgdrüsen, die eine ölige Flüssigkeit in den Mittelteil der Wimpern-Haarfollikel freisetzen
, Talgdrüsen, die eine ölige Flüssigkeit in den Mittelteil der Wimpern-Haarfollikel freisetzen "Augentropfen" werden meist in den - gut vaskularisierten - unteren Bindehautsack (fornix inferior, inferior cul-de-sac)
appliziert. Von hier aus werden Medikamente relativ rasch resorbiert,
abhängig von Verweildauer (Tränenabfluss), Bindung an
Begleitstrukturen, Diffusionskonstante u.a. Mit der Tränenflüssigkeit
gelangen applizierte Pharmaka - über das nasolakrimale System - auf die
Nasenschleimhaut, die ebenfalls gutes Resorptionsvermögen aufweist.
"Augentropfen" werden meist in den - gut vaskularisierten - unteren Bindehautsack (fornix inferior, inferior cul-de-sac)
appliziert. Von hier aus werden Medikamente relativ rasch resorbiert,
abhängig von Verweildauer (Tränenabfluss), Bindung an
Begleitstrukturen, Diffusionskonstante u.a. Mit der Tränenflüssigkeit
gelangen applizierte Pharmaka - über das nasolakrimale System - auf die
Nasenschleimhaut, die ebenfalls gutes Resorptionsvermögen aufweist.  Abbildung) mit jeweils unterschiedlicher Funktion:
Abbildung) mit jeweils unterschiedlicher Funktion:
 Abbildung: Vorderes Auge - Hornhaut, Augenkammern, Ziliarkörper
Abbildung: Vorderes Auge - Hornhaut, Augenkammern, Ziliarkörper
 Das aus 5-6 Zellschichten bestehende Epithelschicht ist ~50 µm dick und hat eine wichtige Barrierefunktion. Sie enthält u.a. dendritische Zellen für die Immunabwehr (nach Antigenkontakt wandern sie in regionale Lymphknoten).
Das aus 5-6 Zellschichten bestehende Epithelschicht ist ~50 µm dick und hat eine wichtige Barrierefunktion. Sie enthält u.a. dendritische Zellen für die Immunabwehr (nach Antigenkontakt wandern sie in regionale Lymphknoten).  Abbildung
unten), sie korrespondieren mit dem Tränenfilm, den sie vermutlich
stabilisieren. Die hochprismatische, mitotisch aktive basale Zellschicht liefert frisches Epithel nach und liegt auf der
Abbildung
unten), sie korrespondieren mit dem Tränenfilm, den sie vermutlich
stabilisieren. Die hochprismatische, mitotisch aktive basale Zellschicht liefert frisches Epithel nach und liegt auf der Bowman-Membran
(lamina limitans anterior), die - etwas mehr als 10 µm dick - aus
Kollagenfasern und Proteoglykanen besteht. Darunter liegt das
Bowman-Membran
(lamina limitans anterior), die - etwas mehr als 10 µm dick - aus
Kollagenfasern und Proteoglykanen besteht. Darunter liegt das Stroma,
mit knapp 0,5 mm Dicke der voluminöseste Hornhautanteil (90%). Es ist
hydrophil und besteht aus - von langgestreckten, synzytiären
Keratinozyten gebildeten - Kollagenlamellen, die gitterförmig
angeordnet sind, ferner Proteoglykanen und Glykosaminoglykanen. Dadurch
ist ein hoher Wasseranteil und gute optische Transparenz gegeben. Das Stroma
enthält auch Immunzellen und Nervenfasern, der Zellanteil beträgt nur
wenige Prozent. Ganz innen befindet sich eine 15µm dünne, aber
reißfeste (bis 2 bar belastbare) Schicht (Dua-Schicht).
Stroma,
mit knapp 0,5 mm Dicke der voluminöseste Hornhautanteil (90%). Es ist
hydrophil und besteht aus - von langgestreckten, synzytiären
Keratinozyten gebildeten - Kollagenlamellen, die gitterförmig
angeordnet sind, ferner Proteoglykanen und Glykosaminoglykanen. Dadurch
ist ein hoher Wasseranteil und gute optische Transparenz gegeben. Das Stroma
enthält auch Immunzellen und Nervenfasern, der Zellanteil beträgt nur
wenige Prozent. Ganz innen befindet sich eine 15µm dünne, aber
reißfeste (bis 2 bar belastbare) Schicht (Dua-Schicht). Die Descemet-Membran
Die Descemet-Membran (lamina
limitans posterior) ist beim Menschen die dickste Basalmembran (bei
Neugeborenen 3 µm, bei erwachsenen Personen bis 10 µm dick). Sie wird
vermutlich vom Endothel gebildet, das sie mechanisch, chemisch und
immunologisch schützt.
(lamina
limitans posterior) ist beim Menschen die dickste Basalmembran (bei
Neugeborenen 3 µm, bei erwachsenen Personen bis 10 µm dick). Sie wird
vermutlich vom Endothel gebildet, das sie mechanisch, chemisch und
immunologisch schützt. Angrenzend an die vordere Augenkammer findet sich die einzellige Endothelzellschicht (~5 µm), deren Zellen mit tight junctions
verbunden sind und eine Schutzfunktion haben. Aktive Transportprozesse tragen zur
Hydratation und damit Transparenz der Hornhaut bei. Zum Kammerwasser
hin tragen die Zellen Mikrozotten, mit der Augenkammer besteht
reger Stoffaustausch.
Angrenzend an die vordere Augenkammer findet sich die einzellige Endothelzellschicht (~5 µm), deren Zellen mit tight junctions
verbunden sind und eine Schutzfunktion haben. Aktive Transportprozesse tragen zur
Hydratation und damit Transparenz der Hornhaut bei. Zum Kammerwasser
hin tragen die Zellen Mikrozotten, mit der Augenkammer besteht
reger Stoffaustausch. Zum Lidschlussreflex s. dort
Zum Lidschlussreflex s. dort Abbildung):
Abbildung):
 Abbildung: Schichten auf der Hornhaut
Abbildung: Schichten auf der Hornhaut
 Ganz außen findet man eine Lipidschicht, ein öliger Film, der - holokrin, d.h. unter Ruptur der Zellmembran, wobei die Zellen untergehen - von den Tarsaldrüsen
(Meibom-Drüsen)
an der Innenseite der Augenlider produziert wird. Diese Schicht deckt die darunterliegende
Flüssigkeitsschicht ab und verhindert dadurch auch das "Ausfließen" der
Tränenflüssigkeit auf die Wangen. In der Nacht (kaum Tränenproduktion)
verdicken
sich Teile dieses Films zum "Schlafsand"
Ganz außen findet man eine Lipidschicht, ein öliger Film, der - holokrin, d.h. unter Ruptur der Zellmembran, wobei die Zellen untergehen - von den Tarsaldrüsen
(Meibom-Drüsen)
an der Innenseite der Augenlider produziert wird. Diese Schicht deckt die darunterliegende
Flüssigkeitsschicht ab und verhindert dadurch auch das "Ausfließen" der
Tränenflüssigkeit auf die Wangen. In der Nacht (kaum Tränenproduktion)
verdicken
sich Teile dieses Films zum "Schlafsand" Die Schicht der Tränenflüssigkeit aus den Tränendrüsen dominiert mit einigen µm Schichtdicke (98% des Gesamtvolumens). Dieser hydrophile Film schützt (Immunfaktoren)
und stabilisiert die Osmolalität (Abdeckung durch die Lipidschicht verringert Verdunstung)
Die Schicht der Tränenflüssigkeit aus den Tränendrüsen dominiert mit einigen µm Schichtdicke (98% des Gesamtvolumens). Dieser hydrophile Film schützt (Immunfaktoren)
und stabilisiert die Osmolalität (Abdeckung durch die Lipidschicht verringert Verdunstung) Die innere Schleimschicht enthält Mucine aus Becherzellen der Bindehaut (Konjunktiva). Diese Schicht liegt direkt der Hornhaut auf und ist ebenfalls hydrophil
Die innere Schleimschicht enthält Mucine aus Becherzellen der Bindehaut (Konjunktiva). Diese Schicht liegt direkt der Hornhaut auf und ist ebenfalls hydrophil Wasser (98-99%)
Wasser (98-99%) anorganische Salze (~1%, hauptsächlich NaCl, isoton)
anorganische Salze (~1%, hauptsächlich NaCl, isoton) Plasmaproteine (~0,2-0,6%, Albumin, Globuline)
Plasmaproteine (~0,2-0,6%, Albumin, Globuline) Glucose
(Epithelversorgung; Glucosekonzentration wie im Blutplasma - ~1 mg/ml -, kann über spezielle Kontaktlinsen
zwecks Ermittlung des Blutzuckerspiegels gemessen werden)
Glucose
(Epithelversorgung; Glucosekonzentration wie im Blutplasma - ~1 mg/ml -, kann über spezielle Kontaktlinsen
zwecks Ermittlung des Blutzuckerspiegels gemessen werden) Aminosäuren, Harnstoff, Amine, Dicarbonsäuren, zahlreiche weitere Metabolite
Aminosäuren, Harnstoff, Amine, Dicarbonsäuren, zahlreiche weitere Metabolite Mucin (~0,8 µm dicke Schutzschicht, Gleitmittel - Viskosität der Tränenflüssigkeit ~1,3 cP, zum Vergleich: Wasser <1 cP, Plasma ~2 cP)
Mucin (~0,8 µm dicke Schutzschicht, Gleitmittel - Viskosität der Tränenflüssigkeit ~1,3 cP, zum Vergleich: Wasser <1 cP, Plasma ~2 cP) Lipide (hydrophobe Schutzschicht). Die ~0,2 µm dicke Lipidschicht (
Lipide (hydrophobe Schutzschicht). Die ~0,2 µm dicke Lipidschicht ( Abbildung oben) enthält Cholesterin, Cholesterinester, Triglyzeride und Phospholipide
Abbildung oben) enthält Cholesterin, Cholesterinester, Triglyzeride und Phospholipide Lacritin - Glykoprotein aus Tränen- und Meibom- Drüsen sowie Epithelzellen in Cornea und Konjunktiva (lacrimal functional unit), auch Speicheldüsen (Lactitin ist auch im Speichel nachweisbar), sekretions- und mitosefördernd (Wundheilung) via Transkriptionsanregung
Lacritin - Glykoprotein aus Tränen- und Meibom- Drüsen sowie Epithelzellen in Cornea und Konjunktiva (lacrimal functional unit), auch Speicheldüsen (Lactitin ist auch im Speichel nachweisbar), sekretions- und mitosefördernd (Wundheilung) via Transkriptionsanregung Lysozym (~0,02-0,06%, greift Bakterienwände an)
Lysozym (~0,02-0,06%, greift Bakterienwände an) Lactoferrin (bakterizid)
Lactoferrin (bakterizid) Lipocaline (an Immunantworten beteiligte detoxifizierende Proteine)
Lipocaline (an Immunantworten beteiligte detoxifizierende Proteine) sIgA (sekretorische Antikörper)
sIgA (sekretorische Antikörper) Hormone (z.B. Prolaktin, ACTH)
Hormone (z.B. Prolaktin, ACTH) Enkephaline
Enkephaline Basale Tränensekretion
(~1 ml/Tag - Kinder ~80 µl/h, Erwachsene ~40 µl/h) hält das Auge
angefeuchtet, schützt und versorgt es mit Nährstoffen (Schirmer-Test s.
unten). Basale Tränenbildung erfolgt unabhängig von
sensorischen Anreizen. Akzessorischen Tränendrüsen unter den
Augenlidern übernehmen die basale Tränensekretion:
Basale Tränensekretion
(~1 ml/Tag - Kinder ~80 µl/h, Erwachsene ~40 µl/h) hält das Auge
angefeuchtet, schützt und versorgt es mit Nährstoffen (Schirmer-Test s.
unten). Basale Tränenbildung erfolgt unabhängig von
sensorischen Anreizen. Akzessorischen Tränendrüsen unter den
Augenlidern übernehmen die basale Tränensekretion: Muköse Krause-sche
Muköse Krause-sche  Drüsen
am Übergang zwischen der oberen und unteren Bindehaut, etwa 40 im
Bereich des Oberlids und 6-8 im Bereich des Unterlids, ihre
Ausführungsgänge vereinigen sich und münden in die fornix conjunctivae;
Drüsen
am Übergang zwischen der oberen und unteren Bindehaut, etwa 40 im
Bereich des Oberlids und 6-8 im Bereich des Unterlids, ihre
Ausführungsgänge vereinigen sich und münden in die fornix conjunctivae;
 Wolfring-
Wolfring-  bzw. Ciaccio-
bzw. Ciaccio-  Drüsen im Bereich der caruncula lacrimalis, größer als die Krause-Drüsen, aber weniger zahlreich (3-5).
Drüsen im Bereich der caruncula lacrimalis, größer als die Krause-Drüsen, aber weniger zahlreich (3-5). Reflektorische Tränensekretion wird über sensorische Afferenzen von Horn- und Bindehaut angeregt und hilft beim Wegspülen oder Neutralisieren von Irritantien (Reizgase,
Staub etc). Sie wird unterstützt durch Vasodilatation / erhöhte Durchblutung
der Tränendrüsen. Die
parasympathische Efferenz lauft über den N. facialis und schaltet im
ggl. pterygopalatinum um (
Reflektorische Tränensekretion wird über sensorische Afferenzen von Horn- und Bindehaut angeregt und hilft beim Wegspülen oder Neutralisieren von Irritantien (Reizgase,
Staub etc). Sie wird unterstützt durch Vasodilatation / erhöhte Durchblutung
der Tränendrüsen. Die
parasympathische Efferenz lauft über den N. facialis und schaltet im
ggl. pterygopalatinum um ( Abbildung).
Abbildung).  Emotional angeregte Sekretion (Weinen) wird durch höhere Gehirnteile ausgelöst und hat soziale Bedeutung
(sie regt z.B.
protektives
Verhalten an, Beispiel: Weinen Frauen, reduziert das Aggression und Sexualantrieb
bei Männern). Die Intensität der Tränensekretion liegt beim Weinen um zwei Zehnerpotenzen über derjenigen der basalen Tränenproduktion. Die Konzentration von Hormonen in den Tränen scheint höher zu sein als bei reflektorisch ausgelöstem Tränenfluss.
Emotional angeregte Sekretion (Weinen) wird durch höhere Gehirnteile ausgelöst und hat soziale Bedeutung
(sie regt z.B.
protektives
Verhalten an, Beispiel: Weinen Frauen, reduziert das Aggression und Sexualantrieb
bei Männern). Die Intensität der Tränensekretion liegt beim Weinen um zwei Zehnerpotenzen über derjenigen der basalen Tränenproduktion. Die Konzentration von Hormonen in den Tränen scheint höher zu sein als bei reflektorisch ausgelöstem Tränenfluss. Abbildung), löst emotional bedingte Tränensekretion aus. Die neuronalen Strukturen, die viszeromotorische,
neuroendokrine und Verhaltensreaktionen kontrollieren, fasst man als zentrales autonomes Netzwerk (central autonomic network CAN) zusammen. Dieses verwaltet emotionale Vorgänge und umfasst u.a.
Präfrontalrinde und limbisches System (Gefühle), Basalganglien und
Thalamus (motorische Gefühlsäußerungen), Hypothalamus (neuroendookrine
Reaktionen), zentrales Höhlengrau (Schmerzmanagement).
Abbildung), löst emotional bedingte Tränensekretion aus. Die neuronalen Strukturen, die viszeromotorische,
neuroendokrine und Verhaltensreaktionen kontrollieren, fasst man als zentrales autonomes Netzwerk (central autonomic network CAN) zusammen. Dieses verwaltet emotionale Vorgänge und umfasst u.a.
Präfrontalrinde und limbisches System (Gefühle), Basalganglien und
Thalamus (motorische Gefühlsäußerungen), Hypothalamus (neuroendookrine
Reaktionen), zentrales Höhlengrau (Schmerzmanagement).
 Abbildung: Steuerung der emotionalen Tränensekretion
Abbildung: Steuerung der emotionalen Tränensekretion

 Bündelt z.B. eine Linse parallele Lichtstrahlen
(Sonnenlicht) in 1/2 m Abstand zu einem Brennpunkt, so beträgt ihre
Brechkraft 2 Dioptrien.
Bündelt z.B. eine Linse parallele Lichtstrahlen
(Sonnenlicht) in 1/2 m Abstand zu einem Brennpunkt, so beträgt ihre
Brechkraft 2 Dioptrien. Dioptrienzahlen
kann man nicht einfach zusammenzählen, es kommt auch auf die Lage der Komponenten im optischen System
an: Die Vorderfläche der Linse liegt 5,6 mm hinter derjeniger der
Hornhaut, die Linse beginnt erst ab hier mit ihrem Beitrag zur
Refraktion. Eine "Starbrille" - nach Entfernung der Linse - hat eine
entsprechend niedrigere Dioptrienzahl von 15: die Brillenlinse liegt vor,
nicht hinter der Hornhaut.
Dioptrienzahlen
kann man nicht einfach zusammenzählen, es kommt auch auf die Lage der Komponenten im optischen System
an: Die Vorderfläche der Linse liegt 5,6 mm hinter derjeniger der
Hornhaut, die Linse beginnt erst ab hier mit ihrem Beitrag zur
Refraktion. Eine "Starbrille" - nach Entfernung der Linse - hat eine
entsprechend niedrigere Dioptrienzahl von 15: die Brillenlinse liegt vor,
nicht hinter der Hornhaut.  Abbildung) ist ein Maß für die Geschwindigkeit, mit der das Licht durch das Medium wandert:
Abbildung) ist ein Maß für die Geschwindigkeit, mit der das Licht durch das Medium wandert:
 Abbildung: Auge als optisches System
Abbildung: Auge als optisches System

 Abbildung: Struktur des Auges, Brechungsindices
Abbildung: Struktur des Auges, Brechungsindices
 Im nichtakkommodierten (Ruhe-) Zustand werden parallel eintreffende Lichtstrahlen auf der Netzhaut zu einem (Bild-) Punkt vereint (
Im nichtakkommodierten (Ruhe-) Zustand werden parallel eintreffende Lichtstrahlen auf der Netzhaut zu einem (Bild-) Punkt vereint ( Abbildung oben)
Abbildung oben) Im perfekt akkommodierten Zustand werden (von einem nahe am Auge liegenden Gegenstandspunkt ausgehende) divergierende Lichtstrahlen auf
der Netzhaut zu einem (Bild-) Punkt vereint. Dies ist durch die Zunahme
der Brechkraft der sich stärker abrundenden Linse bedingt (Mechanismus s. weiter unten)
Im perfekt akkommodierten Zustand werden (von einem nahe am Auge liegenden Gegenstandspunkt ausgehende) divergierende Lichtstrahlen auf
der Netzhaut zu einem (Bild-) Punkt vereint. Dies ist durch die Zunahme
der Brechkraft der sich stärker abrundenden Linse bedingt (Mechanismus s. weiter unten) )
liegt der Fernpunkt "im Unendlichen" (0 dptr), d.h. er bildet bei
Akkommodationsruhe fern gelegene Gegenstände scharf auf der Netzhaut ab.
Sein Fernpunkt liegt bei Verwendung einer 4 dptr-Linse bei 25 cm (1/4
m = 4 dptr).
)
liegt der Fernpunkt "im Unendlichen" (0 dptr), d.h. er bildet bei
Akkommodationsruhe fern gelegene Gegenstände scharf auf der Netzhaut ab.
Sein Fernpunkt liegt bei Verwendung einer 4 dptr-Linse bei 25 cm (1/4
m = 4 dptr). Beispiel: Weitsichtiger Patient (2 dptr), Nahpunkt (unkorrigiert) 20 cm. Akkommodationsbreite = ?
Beispiel: Weitsichtiger Patient (2 dptr), Nahpunkt (unkorrigiert) 20 cm. Akkommodationsbreite = ? Zentrales Sehen: 1 Bogengrad bedeutet auf der Netzhaut eine Strecke von 300 µm. In der fovea centralis (Durchmesser 300-700 µm) sind die Rezeptoren (die Fovea ist ausschließlich mit Zapfen bestückt) am dichtesten gepackt - Abstand etwa 0,3 µm - und
sie sind zu ihren Ganglienzellen 1:1 verschaltet (höchstmögliche Auflösung). Bilden sich hier zwei Punkte so ab, dass zwei betroffene Zapfen durch einen nicht betroffenen
getrennt sind, entspricht das einem Abstand von einer Bogenminute.
Zentrales Sehen: 1 Bogengrad bedeutet auf der Netzhaut eine Strecke von 300 µm. In der fovea centralis (Durchmesser 300-700 µm) sind die Rezeptoren (die Fovea ist ausschließlich mit Zapfen bestückt) am dichtesten gepackt - Abstand etwa 0,3 µm - und
sie sind zu ihren Ganglienzellen 1:1 verschaltet (höchstmögliche Auflösung). Bilden sich hier zwei Punkte so ab, dass zwei betroffene Zapfen durch einen nicht betroffenen
getrennt sind, entspricht das einem Abstand von einer Bogenminute. Außerhalb der Fovea nimmt die Dichte der Zapfen sehr rasch ab, es überwiegen Stäbchen. Beide zusammen vermitteln das periphere Sehen. Hier herrscht das Prinzip der Konzergenz
(viele Photorezeptoren projizieren auf jeweils eine Ganglienzelle).
Dabei werden in der Netzhaut z.B. Bewegungen detektiert, die dann die
Aufmerksamkeit auf sich richten (Fixierung der betreffenden Stelle auf
die Fovea).
Außerhalb der Fovea nimmt die Dichte der Zapfen sehr rasch ab, es überwiegen Stäbchen. Beide zusammen vermitteln das periphere Sehen. Hier herrscht das Prinzip der Konzergenz
(viele Photorezeptoren projizieren auf jeweils eine Ganglienzelle).
Dabei werden in der Netzhaut z.B. Bewegungen detektiert, die dann die
Aufmerksamkeit auf sich richten (Fixierung der betreffenden Stelle auf
die Fovea). Ein Patient erkennt Testmuster in der Zeile mit dem Index "6" nur aus
≤3 m Entfernung. Sein Visus beträgt? ... 0,5 (3:6)
Ein Patient erkennt Testmuster in der Zeile mit dem Index "6" nur aus
≤3 m Entfernung. Sein Visus beträgt? ... 0,5 (3:6) Sehprobentafeln enthalten Reizmuster (Optotypen, z.B. Buchstaben, Zahlen, Ringe, Haken..) mit normierten Balkenbreiten bzw. Lücken (aus entsprechendem Abstand betrachtet eine Winkelminute Größe,
Sehprobentafeln enthalten Reizmuster (Optotypen, z.B. Buchstaben, Zahlen, Ringe, Haken..) mit normierten Balkenbreiten bzw. Lücken (aus entsprechendem Abstand betrachtet eine Winkelminute Größe,  Abbildung):
Abbildung): Buchstaben
Buchstaben Zahlen
Zahlen Pflüger-Haken (nach welcher Seite offen?)
Pflüger-Haken (nach welcher Seite offen?) Landolt-Ringe (wohin ist die Lücke gerichtet?)
Landolt-Ringe (wohin ist die Lücke gerichtet?) Kinderbilder
Kinderbilder Der Visus beträgt >1 (erforderlicher retinaler Mindestabstand
kleiner als 5 µm), wenn das Auflösungsvermögen der Netzhaut
überdurchschnittlich hoch ist ("Adlerblick").
Der Visus beträgt >1 (erforderlicher retinaler Mindestabstand
kleiner als 5 µm), wenn das Auflösungsvermögen der Netzhaut
überdurchschnittlich hoch ist ("Adlerblick"). 
 Abbildung: Interdigitierende Zellfortsätze sichern die wechselseitige Positionierung von Linsenfaserzellen
Abbildung: Interdigitierende Zellfortsätze sichern die wechselseitige Positionierung von Linsenfaserzellen 
 Abbildung),
sodass sie der Akkommodation elastisch folgen können. Durch diese Architektur können sie ihre
Anordnung zueinander erhalten - was für die optische Qualität der Linse wichtig ist -, ohne die extrazelluläre Passage von Ionen,
Metaboliten und Nährstoffen wesentlich zu behindern. Die Zellen
enthalten transparente Strukturproteine (Crystalline), die auch in der
Hornhaut vorkommen und den optischen Refraktionsindex erhöhen.
Abbildung),
sodass sie der Akkommodation elastisch folgen können. Durch diese Architektur können sie ihre
Anordnung zueinander erhalten - was für die optische Qualität der Linse wichtig ist -, ohne die extrazelluläre Passage von Ionen,
Metaboliten und Nährstoffen wesentlich zu behindern. Die Zellen
enthalten transparente Strukturproteine (Crystalline), die auch in der
Hornhaut vorkommen und den optischen Refraktionsindex erhöhen. Abnahme der
Elastizität der Linse mit der Folge reduzierter Akkommodationsbreite
(Presbyopie) und Myopisierung (Korrektur: "Lesebrille"),
Abnahme der
Elastizität der Linse mit der Folge reduzierter Akkommodationsbreite
(Presbyopie) und Myopisierung (Korrektur: "Lesebrille"),  zunehmende Verfärbung / Trübung
mit der Folge reduzierter Lichdurchlässigkeit und optischer Qualität: Katarakt, "grauer Star". Therapie: Phakoemulsifikation
zunehmende Verfärbung / Trübung
mit der Folge reduzierter Lichdurchlässigkeit und optischer Qualität: Katarakt, "grauer Star". Therapie: Phakoemulsifikation (Fraktionierung des Linkenkerns mittels Ultraschall), Absaugung der
Trümmer mittels Kanüle, Einsetzen einer künstlichen Linse mit
gewünschter Refraktion, zusätzlich Brille mit entsprechendem
Multifokalglas (die künstliche Linse kann nicht akkommodieren).
(Fraktionierung des Linkenkerns mittels Ultraschall), Absaugung der
Trümmer mittels Kanüle, Einsetzen einer künstlichen Linse mit
gewünschter Refraktion, zusätzlich Brille mit entsprechendem
Multifokalglas (die künstliche Linse kann nicht akkommodieren). ). Die Zonulafasern verfügen über zugfeste Mikrofibrillen, mittels derer beständig Kraft (nach außen gerichter Zug der Zonulafasern) auf die Linsenkapsel übertragen und die Linse dadurch in einem nichtakkommodierten Zustand mit geringerer Refraktion gehalten werden kann.
). Die Zonulafasern verfügen über zugfeste Mikrofibrillen, mittels derer beständig Kraft (nach außen gerichter Zug der Zonulafasern) auf die Linsenkapsel übertragen und die Linse dadurch in einem nichtakkommodierten Zustand mit geringerer Refraktion gehalten werden kann.  s. z.B. Wilson 1993, Koshits et al 2020). Die exakte Biomechanik
der Kraftübertragung vom Ziliarkörper auf die Linse ist noch nicht
endgültig geklärt.
s. z.B. Wilson 1993, Koshits et al 2020). Die exakte Biomechanik
der Kraftübertragung vom Ziliarkörper auf die Linse ist noch nicht
endgültig geklärt. bedeutet, dass die Lichtstrahlen von Gegenstandspunkten nicht mehr auf
(nunmehr virtuell retroretinal gelegene) Abbildungspunkte auf der
Netzhaut gebündelt werden können.
bedeutet, dass die Lichtstrahlen von Gegenstandspunkten nicht mehr auf
(nunmehr virtuell retroretinal gelegene) Abbildungspunkte auf der
Netzhaut gebündelt werden können. 
 Abbildung)
Abbildung)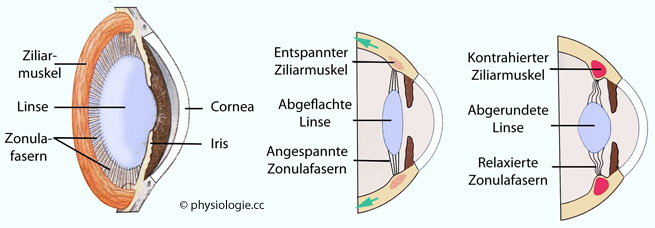
 Abbildung: Mechanismus der Akkommodation
Abbildung: Mechanismus der Akkommodation

 Abbildung: Anpassung des Auges an die Distanz zum betrachteten Gegenstand
Abbildung: Anpassung des Auges an die Distanz zum betrachteten Gegenstand
 Die Akkommodation nimmt zu, wenn näher am Auge gelegene Gegenstände betrachtet werden (optiko-okulomotorischer
Hirnnervenreflex über Edinger-Westphal-Kern, ggl. ciliare,
Ziliarmuskel) - die
Linse wird dabei entspannt und rundet sich ab, ihre Brechkraft steigt (
Die Akkommodation nimmt zu, wenn näher am Auge gelegene Gegenstände betrachtet werden (optiko-okulomotorischer
Hirnnervenreflex über Edinger-Westphal-Kern, ggl. ciliare,
Ziliarmuskel) - die
Linse wird dabei entspannt und rundet sich ab, ihre Brechkraft steigt ( Abbildung).
Abbildung). Zykloplegika: Atropin hemmt über Blockade muskarinischer parasympathischer Rezeptoren vom M3-Typ den Ziliarmuskel und verhindert die Akkommodation (Zykloplegie
Zykloplegika: Atropin hemmt über Blockade muskarinischer parasympathischer Rezeptoren vom M3-Typ den Ziliarmuskel und verhindert die Akkommodation (Zykloplegie  ).
). ). Die stärkste Abnahme der
Brechkraft erfolgt im 5. Lebensjahrzehnt.
). Die stärkste Abnahme der
Brechkraft erfolgt im 5. Lebensjahrzehnt. 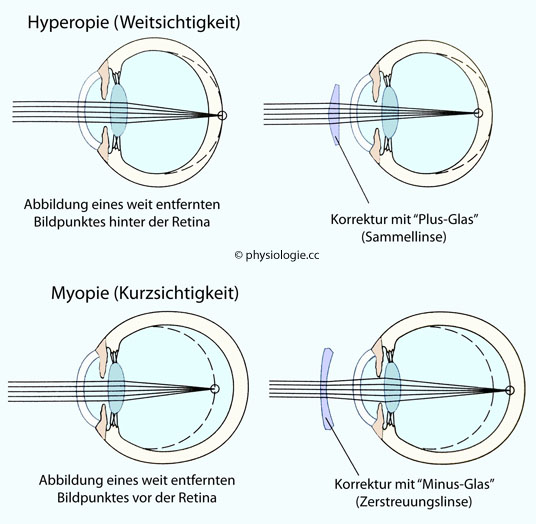
 Abbildung: Refraktionsanomalien und ihre Korrektur
Abbildung: Refraktionsanomalien und ihre Korrektur
 Bei
Weitsichtigkeit (Hypermetropie) ist die Brechkraft des Auges zu gering
(das Auge zu kurz), was durch Kontraktion des Ziliarmuskels ausgeglichen wird
(weitsichtige Kinder klagen oft zuerst über Kopfschmerzen, die mit
andauernder Akkommodation erklärt werden). Der Visus ist normal, der
Blick
auf nahe Gegenstände erschwert.
Bei
Weitsichtigkeit (Hypermetropie) ist die Brechkraft des Auges zu gering
(das Auge zu kurz), was durch Kontraktion des Ziliarmuskels ausgeglichen wird
(weitsichtige Kinder klagen oft zuerst über Kopfschmerzen, die mit
andauernder Akkommodation erklärt werden). Der Visus ist normal, der
Blick
auf nahe Gegenstände erschwert.  Kurzsichtigkeit
(Myopie
Kurzsichtigkeit
(Myopie  ) erniedrigt den Visus, die Brechkraft ist zu hoch (das Auge zu
lang); der Kurzsichtige benötigt zur Korrektur Streulinsen
(”Minus-Gläser“). Diese erkennt man an ihrem verkleinernden Effekt, und
sie sind am Rand dicker als in der Mitte. Meist ist eine Verlängerung des Bulbus die Ursache für eine Myopie.
) erniedrigt den Visus, die Brechkraft ist zu hoch (das Auge zu
lang); der Kurzsichtige benötigt zur Korrektur Streulinsen
(”Minus-Gläser“). Diese erkennt man an ihrem verkleinernden Effekt, und
sie sind am Rand dicker als in der Mitte. Meist ist eine Verlängerung des Bulbus die Ursache für eine Myopie. Eine Veränderung der Bulbuslänge um einen Millimeter kann durch eine Veränderung der Brechkraft um drei Dioptrien kompensiert werden (verlängerter Bulbus → Myopie,
verkürzter Bulbus → Hypermetropie).
Eine Veränderung der Bulbuslänge um einen Millimeter kann durch eine Veränderung der Brechkraft um drei Dioptrien kompensiert werden (verlängerter Bulbus → Myopie,
verkürzter Bulbus → Hypermetropie). Astigmatismus
Astigmatismus
 liegt bei ungleicher Brechung in verschiedenen Drehachsen vor. Die
Korrektur erfolgt durch ”Zylinder-Gläser“, die in verschiedenen
Drehachsen unterschiedliche Brechkraft haben - a-stigma: kein Punkt
(Brennpunkt), sondern zwei senkrecht aufeinander stehende Brennlinien -
daher "Stabsichtigkeit".
liegt bei ungleicher Brechung in verschiedenen Drehachsen vor. Die
Korrektur erfolgt durch ”Zylinder-Gläser“, die in verschiedenen
Drehachsen unterschiedliche Brechkraft haben - a-stigma: kein Punkt
(Brennpunkt), sondern zwei senkrecht aufeinander stehende Brennlinien -
daher "Stabsichtigkeit". (Regenbogenhaut) dient
als Lichtblende; sie umrahmt die Öffnung für den Lichtdurchtritt, die
Pupille.
(Regenbogenhaut) dient
als Lichtblende; sie umrahmt die Öffnung für den Lichtdurchtritt, die
Pupille.  Die Pupillenweite beider Augen sollte ident sein (Isokorie
Die Pupillenweite beider Augen sollte ident sein (Isokorie ), bei veränderter Beleuchtungsstärke kommt es zu einer konsensuellen Lichtreaktion. Sind die Pupillen ungleich weit, spricht man von Anisokorie.
), bei veränderter Beleuchtungsstärke kommt es zu einer konsensuellen Lichtreaktion. Sind die Pupillen ungleich weit, spricht man von Anisokorie.
 Abbildung: Merkhilfe
Abbildung: Merkhilfe
 Eine Verengerung (Konstriktion) der Pupille (Miosis
Eine Verengerung (Konstriktion) der Pupille (Miosis )
wird durch Kontraktion ringförmig verlaufender, gitternetzartig
angeordneter Fasern des m. sphincter pupillae bewirkt und ist eine parasympathische Funktion (Fasern laufen über den N. oculomotorius), wird also cholinerg angeregt (über M3-Rezeptoren).
)
wird durch Kontraktion ringförmig verlaufender, gitternetzartig
angeordneter Fasern des m. sphincter pupillae bewirkt und ist eine parasympathische Funktion (Fasern laufen über den N. oculomotorius), wird also cholinerg angeregt (über M3-Rezeptoren).  Eine Erweiterung (Dilatation) der Pupille (Mydriasis
Eine Erweiterung (Dilatation) der Pupille (Mydriasis ) erfolgt durch Kontraktion der radiär angeordneten Fasern des m. dilatator pupillae und ist eine sympathische Funktion (Grenzstrang, Th 1) und wird noradrenerg angeregt (über α1-Rezeptoren).
) erfolgt durch Kontraktion der radiär angeordneten Fasern des m. dilatator pupillae und ist eine sympathische Funktion (Grenzstrang, Th 1) und wird noradrenerg angeregt (über α1-Rezeptoren). Merkregel: Ist dir jemand sympathisch, gehen dir die Augen auf (vgl.
Atropineffekt, atropa belladonna: soziales Signal). Aber auch: "Vor
Schreck geweitete Pupille" (Stressreaktion). Oder: Pupillenerweiterung
bei Dunkelheit (gut zu erkennen bei Aufnahmen im Infrarotbereich).
Merkregel: Ist dir jemand sympathisch, gehen dir die Augen auf (vgl.
Atropineffekt, atropa belladonna: soziales Signal). Aber auch: "Vor
Schreck geweitete Pupille" (Stressreaktion). Oder: Pupillenerweiterung
bei Dunkelheit (gut zu erkennen bei Aufnahmen im Infrarotbereich).
 Abbildung: Der sympathische Reflexweg für die Pupillendilatation
Abbildung: Der sympathische Reflexweg für die Pupillendilatation
 Abbildung):
Abbildung): 1. Neuron im tractus hypothalamicospinalis - vom posterioren Hypothalamus durch den dorsolateralen Hirnstamm - zu sympathisch-präganglionären Neuronen des ziliospinalen Zentrum (Budge's center
1. Neuron im tractus hypothalamicospinalis - vom posterioren Hypothalamus durch den dorsolateralen Hirnstamm - zu sympathisch-präganglionären Neuronen des ziliospinalen Zentrum (Budge's center ) des intermediolateralen Rückenmarks im Bereich C8-Th2.
) des intermediolateralen Rückenmarks im Bereich C8-Th2. 2.
Neuron (präganglionär) vom ziliospinalen Zentrum über den Bereich der
Lungenspitze zu sympathisch-postganglionären Neuronen im ganglion cervicale superius im Bereich des 2. Halswirbels. Dieses sympathische Ganglion
ist das größte und am weitesten kranial gelegene im Halsbereich. Es stellt die Grundeinstellung der Pupillenweite ein
und wirkt auf die mm. dilatatores
pupillae; bei plötzlich sinkendem Lichtfluss sinkt der
parasympathische, und steigt der sympathische Einfluss auf die Pupille, ihr Durchmesser nimmt zu (Mydriasis).
2.
Neuron (präganglionär) vom ziliospinalen Zentrum über den Bereich der
Lungenspitze zu sympathisch-postganglionären Neuronen im ganglion cervicale superius im Bereich des 2. Halswirbels. Dieses sympathische Ganglion
ist das größte und am weitesten kranial gelegene im Halsbereich. Es stellt die Grundeinstellung der Pupillenweite ein
und wirkt auf die mm. dilatatores
pupillae; bei plötzlich sinkendem Lichtfluss sinkt der
parasympathische, und steigt der sympathische Einfluss auf die Pupille, ihr Durchmesser nimmt zu (Mydriasis). 3.
Neuron (postganglionär) vom oberen Halsganglion entlang der a. carotis
interna, des sinus cavernosus und des N. ophthalmicus zum Auge; im
Ziliarnerv (gemischt sympathisch / parasympathisch) erreichen autonome
Nervenfasern die vordere Augenpartie.
3.
Neuron (postganglionär) vom oberen Halsganglion entlang der a. carotis
interna, des sinus cavernosus und des N. ophthalmicus zum Auge; im
Ziliarnerv (gemischt sympathisch / parasympathisch) erreichen autonome
Nervenfasern die vordere Augenpartie. 
 Abbildung: Parasympathischer
Pupillenreflex (bei Erhöhung des Lichtflusses in das Auge) und
Akkommodationsreflex (bei Annäherung des betrachteten Gegenstandes)
Abbildung: Parasympathischer
Pupillenreflex (bei Erhöhung des Lichtflusses in das Auge) und
Akkommodationsreflex (bei Annäherung des betrachteten Gegenstandes)
 Abbildung) aus. Die Pupillen verengen sich dabei innerhalb einer Sekunde (Latenzzeit 0,2 s) in beiden Augen in gleicher Weise
(konsensuell: Licht in ein Auge - gleiche Pupillenverengung
an beiden Augen). Der Edinger-Westphal-Kern
Abbildung) aus. Die Pupillen verengen sich dabei innerhalb einer Sekunde (Latenzzeit 0,2 s) in beiden Augen in gleicher Weise
(konsensuell: Licht in ein Auge - gleiche Pupillenverengung
an beiden Augen). Der Edinger-Westphal-Kern  sendet efferente Fasern mit dem N. oculomotorius
(III) zum ganglion ciliare in der Orbita, und dieses steuert den m. sphincter pupillae
in der Iris.
sendet efferente Fasern mit dem N. oculomotorius
(III) zum ganglion ciliare in der Orbita, und dieses steuert den m. sphincter pupillae
in der Iris.  .
.  Abbildung) integriert, der bei Annäherung eines betrachteten Gegenstandes an das Gesicht
auftritt. Der Reflexweg läuft über die seitlichen Kniehöcker und die
Sehrinde des Okzipitallappens. Das Prätektum schaltet den
Okulomotoriuskern ein; die Konvergenz-Komponente
läuft über den Unterkern, der den m. rectus medialis anregt. Die
Einschaltung des Edinger-Westphal-Kerns erfolgt analog zum
Pupillenreflex.
Abbildung) integriert, der bei Annäherung eines betrachteten Gegenstandes an das Gesicht
auftritt. Der Reflexweg läuft über die seitlichen Kniehöcker und die
Sehrinde des Okzipitallappens. Das Prätektum schaltet den
Okulomotoriuskern ein; die Konvergenz-Komponente
läuft über den Unterkern, der den m. rectus medialis anregt. Die
Einschaltung des Edinger-Westphal-Kerns erfolgt analog zum
Pupillenreflex. Das Prätectum (prätektale Region) ist Teil des Epithalamus. Es erhält Afferenzen aus der Netzhaut und grenzt
direkt an die oberen Vierhügel des Mittelhirns. Seine Neuronengruppen
(mindestens 5 Kerne) beteiligen sich an der Steuerung von
Das Prätectum (prätektale Region) ist Teil des Epithalamus. Es erhält Afferenzen aus der Netzhaut und grenzt
direkt an die oberen Vierhügel des Mittelhirns. Seine Neuronengruppen
(mindestens 5 Kerne) beteiligen sich an der Steuerung von  Pupillenreflexen,
Pupillenreflexen,  Akkommodation und
Akkommodation und
 physiologischen Nystagmen.
physiologischen Nystagmen.
 Konvergenz (die Augen gehen automatisch in "Pseudo-Schielstellung", um die optischen Achsen auf der macula zu halten),
Konvergenz (die Augen gehen automatisch in "Pseudo-Schielstellung", um die optischen Achsen auf der macula zu halten),  Akkommodation (Naheinstellung) und
Akkommodation (Naheinstellung) und  Miosis (optischer Vorteil: weniger Randstrahlen).
Miosis (optischer Vorteil: weniger Randstrahlen).  Zusammensetzung
Zusammensetzung  Abfluss
Abfluss  Augeninnendruck
Augeninnendruck  Tonometrie
Tonometrie Funktionen des Kammerwassers: Mechanische Stützung (Augeninnendruck) sowie Versorgung von Hornhaut und Linse (die über keine Blutgefäße verfügen) mit Nährstoffen, Abtransport von Abbauprodukten.
Funktionen des Kammerwassers: Mechanische Stützung (Augeninnendruck) sowie Versorgung von Hornhaut und Linse (die über keine Blutgefäße verfügen) mit Nährstoffen, Abtransport von Abbauprodukten.
 Abbildung: Bildung und Abfluss des Kammerwassers
Abbildung: Bildung und Abfluss des Kammerwassers
 Einerseits müssen Infektionen
abgewehrt werden - Ziliarkörper, Iris und Chorioidea enthalten
zahlreiche Immunzellen wie dendritische Zellen, Makrophagen, Mastzellen -,
Einerseits müssen Infektionen
abgewehrt werden - Ziliarkörper, Iris und Chorioidea enthalten
zahlreiche Immunzellen wie dendritische Zellen, Makrophagen, Mastzellen -,
 andererseits soll das Auge nicht durch Entzündungsvorgänge
(irreversibel) geschädigt werden. Dazu verfügt es über ein spezielles
Muster an (vor Entzündungen) schützenden Mechanismen, z.B. exprimieren
Zellen viel Fas-Ligand (FasL), sodass T-Lymphozyten (die über Fas verfügen) einer Apoptose ausgeliefert sind, bevor sie aktiv werden können.
andererseits soll das Auge nicht durch Entzündungsvorgänge
(irreversibel) geschädigt werden. Dazu verfügt es über ein spezielles
Muster an (vor Entzündungen) schützenden Mechanismen, z.B. exprimieren
Zellen viel Fas-Ligand (FasL), sodass T-Lymphozyten (die über Fas verfügen) einer Apoptose ausgeliefert sind, bevor sie aktiv werden können. Elektrolyte (Osmolalität hauptsächlich durch NaCl):
Elektrolyte (Osmolalität hauptsächlich durch NaCl):  Glucose, Aminosäuren
(Substrat für Energiestoffwechsel, Bausteine für Proteinsynthese:
Posteriore Corneaschichten, trabekuläres Maschenwerk im Kammerwinkel, Linse, anteriore Glaskörperanteile)
Glucose, Aminosäuren
(Substrat für Energiestoffwechsel, Bausteine für Proteinsynthese:
Posteriore Corneaschichten, trabekuläres Maschenwerk im Kammerwinkel, Linse, anteriore Glaskörperanteile) Ascorbinsäure (Antioxidans)
Ascorbinsäure (Antioxidans) Komponenten des Immunsystems, z.B. Immunglobuline und antigenpräsentierende Zellen
(APC). Gelangt ein Antigen in die vordere Augenkammer, werden dort
befindliche APC aktiviert. Antigene gelangen über den
Kammerwasserabfluss in den Blutkreislauf und zur Milz; Plasmazellen, die nicht-komplementbindende Antikörper produzieren, zytotoxische T-Lymphozyten sowie Zytokine, deren Muster einer Th2-Reaktion entspricht, werden in solchen Fällen aktiviert
Komponenten des Immunsystems, z.B. Immunglobuline und antigenpräsentierende Zellen
(APC). Gelangt ein Antigen in die vordere Augenkammer, werden dort
befindliche APC aktiviert. Antigene gelangen über den
Kammerwasserabfluss in den Blutkreislauf und zur Milz; Plasmazellen, die nicht-komplementbindende Antikörper produzieren, zytotoxische T-Lymphozyten sowie Zytokine, deren Muster einer Th2-Reaktion entspricht, werden in solchen Fällen aktiviert

 Glutathion (GSH) als Redox-Puffer, dient dem Oxidationsschutz
Glutathion (GSH) als Redox-Puffer, dient dem Oxidationsschutz H2CO3
H2CO3 H+ + HCO3-) bei der Kammerwassersekretion.
H+ + HCO3-) bei der Kammerwassersekretion.  Folglich reduziert die Gabe von Carboanhydrasehemmern (z.B. Acetazolamid) die Kammerwasserproduktion und senkt somit den Augeninnendruck (s. unten), dessen Höhe ja auf einer Balance von Bildung und Abfluss beruht (Glaukombehandlung).
Folglich reduziert die Gabe von Carboanhydrasehemmern (z.B. Acetazolamid) die Kammerwasserproduktion und senkt somit den Augeninnendruck (s. unten), dessen Höhe ja auf einer Balance von Bildung und Abfluss beruht (Glaukombehandlung). Physiologischer Pupillenwiderstand: Sein Betrag schwankt mit dem Öffnungszustand der Linsen-Iris-Barriere. Das in die hintere Augenkammer (Volumen ~50 µl) sezernierte Kammerwasser muss zunächst
den Spaltraum zwischen Linsenvorderfläche und Irisrückfläche passieren,
um in die vordere Augenkammer zu gelangen. Liegt die Iris kontinuierlich ringförmig der Linse an, strömt kein Kammerwasser nach vorne. Erst
wenn der steigende Druck in der hinteren Kammer die Iris von der Linse
abhebt, öffnet sich dieser ventilartige Verschluss und Flüssigkeit
strömt in die vordere Kammer. Die Öffnung erfolgt sporadisch, so wie
die pulsierende Strömung des Kammerwassers in die vordere Augenkammer.
Physiologischer Pupillenwiderstand: Sein Betrag schwankt mit dem Öffnungszustand der Linsen-Iris-Barriere. Das in die hintere Augenkammer (Volumen ~50 µl) sezernierte Kammerwasser muss zunächst
den Spaltraum zwischen Linsenvorderfläche und Irisrückfläche passieren,
um in die vordere Augenkammer zu gelangen. Liegt die Iris kontinuierlich ringförmig der Linse an, strömt kein Kammerwasser nach vorne. Erst
wenn der steigende Druck in der hinteren Kammer die Iris von der Linse
abhebt, öffnet sich dieser ventilartige Verschluss und Flüssigkeit
strömt in die vordere Kammer. Die Öffnung erfolgt sporadisch, so wie
die pulsierende Strömung des Kammerwassers in die vordere Augenkammer. 
 Abbildung: Abflusswege für das Kammerwasser
Abbildung: Abflusswege für das Kammerwasser
 Trabel- und uveoskleraler Widerstand: Aus der vorderen Augenkammer erfolgt der Abfluss des Kammerwassers auf zwei Wegen (
Trabel- und uveoskleraler Widerstand: Aus der vorderen Augenkammer erfolgt der Abfluss des Kammerwassers auf zwei Wegen ( Abbildung):
Abbildung): Trabekulär (Hauptweg, "konventionell") über den Schlemm'schen Kanal und über
20-30 radiär liegende Sammelkanäle in episklerale Venen. Auf diesem Weg
verlassen 80-95% des Kammerwassers die vordere Kammer, der Betrag ist
druckabhängig. Der
Schlemm'sche Kanal verfügt über Klappen, was die Strömung der Flüssigkeit in Richtung Venen sicherstellt.
Trabekulär (Hauptweg, "konventionell") über den Schlemm'schen Kanal und über
20-30 radiär liegende Sammelkanäle in episklerale Venen. Auf diesem Weg
verlassen 80-95% des Kammerwassers die vordere Kammer, der Betrag ist
druckabhängig. Der
Schlemm'sche Kanal verfügt über Klappen, was die Strömung der Flüssigkeit in Richtung Venen sicherstellt. Uveoskleral (alternativ, "unkonventionell"): 5-20% des
Kammerwasserabflusses in venöse Gefäße der Lederhaut. Dieser Weg kann
bei mangelhaftem Abfluss durch den Hauptweg (Glaukom) an Bedeutung
gewinnen.
Uveoskleral (alternativ, "unkonventionell"): 5-20% des
Kammerwasserabflusses in venöse Gefäße der Lederhaut. Dieser Weg kann
bei mangelhaftem Abfluss durch den Hauptweg (Glaukom) an Bedeutung
gewinnen.
 Augeninnendruck (sitzende Position)
Augeninnendruck (sitzende Position)
 Abbildung: Augeninnendruck bei zunehmendem Volumen
Abbildung: Augeninnendruck bei zunehmendem Volumen
 Abbildung). Das
Volumen der flüssigkeitsgefüllten Räume (vordere plus hintere
Augenkammer) beträgt 0,2 bis 0,4 ml.
Abbildung). Das
Volumen der flüssigkeitsgefüllten Räume (vordere plus hintere
Augenkammer) beträgt 0,2 bis 0,4 ml. Fast alle Messungen des Augeninnendrucks erfolgen in der Praxis
nichtinvasiv, d.h. der Druck wird nicht direkt im Auge gemessen,
sondern aus Verformung der Hornhaut bei Druckausübung auf das Auge -
unter Berührung des Messsystems (Impression, Applanation) oder
berührungsfrei (z.B. mittels Luftstoß) - ermittelt. Solche indirekten
Methoden sind naturgemäß fehleranfällig, haben sich aber in der Praxis
bewährt und erzielen hinlängliche Präzision.
Fast alle Messungen des Augeninnendrucks erfolgen in der Praxis
nichtinvasiv, d.h. der Druck wird nicht direkt im Auge gemessen,
sondern aus Verformung der Hornhaut bei Druckausübung auf das Auge -
unter Berührung des Messsystems (Impression, Applanation) oder
berührungsfrei (z.B. mittels Luftstoß) - ermittelt. Solche indirekten
Methoden sind naturgemäß fehleranfällig, haben sich aber in der Praxis
bewährt und erzielen hinlängliche Präzision. Bei der (klassischen) Impressionstonometrie nach
Schiötz wird das Tonometer bei
liegenden Personen auf das Auge gesetzt und die (druckabhängige) Eindringtiefe eines Messstiftes ermittelt (bei abnormer Rigidität des Augapfels können falsche Werte resultieren).
Bei der (klassischen) Impressionstonometrie nach
Schiötz wird das Tonometer bei
liegenden Personen auf das Auge gesetzt und die (druckabhängige) Eindringtiefe eines Messstiftes ermittelt (bei abnormer Rigidität des Augapfels können falsche Werte resultieren). Eine Applanationstonometrie (
Eine Applanationstonometrie (  Abbildung) erfolgt an sitzenden
Personen. Nach Gabe fluoreszierender
Augentropfen wird die (druckabhängige) Größe der Abplattungsfläche bei
Ausübung eines Druckes auf das Auge unter UV-Licht ermittelt.
Abbildung) erfolgt an sitzenden
Personen. Nach Gabe fluoreszierender
Augentropfen wird die (druckabhängige) Größe der Abplattungsfläche bei
Ausübung eines Druckes auf das Auge unter UV-Licht ermittelt.
 Abbildung: Applanationstonometrie
Abbildung: Applanationstonometrie
 Will man einen direkten Kontekt mit der Hornhaut meiden, kann man den
intraokularen Druck durch das Lid hindurch am geschlossenen Auge
mittels transpalpebraler skleraler
Tonometrie bestimmen - mittels mechanischem Sensor in liegender oder
sitzender Körperposition mit um 45° nach oben gerichtetem Auge.
Will man einen direkten Kontekt mit der Hornhaut meiden, kann man den
intraokularen Druck durch das Lid hindurch am geschlossenen Auge
mittels transpalpebraler skleraler
Tonometrie bestimmen - mittels mechanischem Sensor in liegender oder
sitzender Körperposition mit um 45° nach oben gerichtetem Auge. Mit der Dynamic Contour-Tonometrie (DCT)
wird der Augeninnendruck mittels in den Tonometerkopf eingebautem
Drucksensor gemessen, der Druck zwischen Sensor und Hornhaut entspricht
dem intraokularen Druck. Bei dieser Methode wird die Hornhaut nur
leicht abgeflacht und behält weitgehend ihre dynamische Verformbarkeit. So können auch Pulskurven des Augeninnendrucks
registriert werden.
Mit der Dynamic Contour-Tonometrie (DCT)
wird der Augeninnendruck mittels in den Tonometerkopf eingebautem
Drucksensor gemessen, der Druck zwischen Sensor und Hornhaut entspricht
dem intraokularen Druck. Bei dieser Methode wird die Hornhaut nur
leicht abgeflacht und behält weitgehend ihre dynamische Verformbarkeit. So können auch Pulskurven des Augeninnendrucks
registriert werden. Weitgehender Standard in der Ordination ist die (wenn auch etwas
weniger genaue) berührungsfreie Messung der durch einen Luft-Jet verursachten Verformung der Hornhaut (Non-Contact-, air puff- Tonometrie, NCT,
Weitgehender Standard in der Ordination ist die (wenn auch etwas
weniger genaue) berührungsfreie Messung der durch einen Luft-Jet verursachten Verformung der Hornhaut (Non-Contact-, air puff- Tonometrie, NCT,  Abbildung). Diese Methode wird nicht nur von
medizinischem Personal, sondern zusehends auch von Augenoptikern angewendet.
Abbildung). Diese Methode wird nicht nur von
medizinischem Personal, sondern zusehends auch von Augenoptikern angewendet.
 Abbildung: Berührungsfreie Tonometrie (NCT)
Abbildung: Berührungsfreie Tonometrie (NCT)
 Eine ungenaue Schätzung des
Augeninnendrucks
kann auch mittels Palpation erfolgen (orientierende Erstuntersuchung):
Die untersuchte Person schließt die Augen, zwei Finger drücken
abwechselnd auf den Augapfel, der Druck wird über die Verformbarkeit des Augapfels eingestuft (weich? hart?).
Eine ungenaue Schätzung des
Augeninnendrucks
kann auch mittels Palpation erfolgen (orientierende Erstuntersuchung):
Die untersuchte Person schließt die Augen, zwei Finger drücken
abwechselnd auf den Augapfel, der Druck wird über die Verformbarkeit des Augapfels eingestuft (weich? hart?). schätzt die
Tränenproduktion ab: Ein Papierstreifen (25 x 5 mm) wird in den
Bindehautsack placiert; nach 5 Minuten sollte eine 15 mm lange
Befeuchtungszone auftreten (basale Sekretion).
schätzt die
Tränenproduktion ab: Ein Papierstreifen (25 x 5 mm) wird in den
Bindehautsack placiert; nach 5 Minuten sollte eine 15 mm lange
Befeuchtungszone auftreten (basale Sekretion). Katarakt
Katarakt  (grauer Star: Linsentrübung meist unbekannter Ursache, oft im Alter auftretend) ist weltweit die häufigste Erblindungsursache.
Die operative Linsenentfernung mit Ersatz durch eine Kunststofflinse
behebt die Sichtstörung und ist eine der am häufigsten durchgeführten
Operationen (s. oben).
(grauer Star: Linsentrübung meist unbekannter Ursache, oft im Alter auftretend) ist weltweit die häufigste Erblindungsursache.
Die operative Linsenentfernung mit Ersatz durch eine Kunststofflinse
behebt die Sichtstörung und ist eine der am häufigsten durchgeführten
Operationen (s. oben). Bei Menschen über 50 Jahren ist eine Erblindung häufig durch altersabhängige Makuladegeneration bedingt. Bei 4/5 der Fälle liegt eine trockene Form
vor, bei der es zu Ablagerungen von Lipiden und anderen
Stoffwechselendprodukten unter das Pigmentepithel kommt, das dadurch
degeneriert. Dieser Zustand kann in eine feuchte Form übergehen, bei der es zum Einwachsen von Gefäßen und Ödembildung kommt.
Bei Menschen über 50 Jahren ist eine Erblindung häufig durch altersabhängige Makuladegeneration bedingt. Bei 4/5 der Fälle liegt eine trockene Form
vor, bei der es zu Ablagerungen von Lipiden und anderen
Stoffwechselendprodukten unter das Pigmentepithel kommt, das dadurch
degeneriert. Dieser Zustand kann in eine feuchte Form übergehen, bei der es zum Einwachsen von Gefäßen und Ödembildung kommt.  Behinderung des
Abflusses von Kammerwasser erhöht den Druck über den physiologischen Grenzwert von ~3 kPa (Glaukom
Behinderung des
Abflusses von Kammerwasser erhöht den Druck über den physiologischen Grenzwert von ~3 kPa (Glaukom  ,
grüner Star) und
gefährdet Netzhautdurchblutung und Sehnerven. Farb-Fehlwahrnehmungen
und Ausfälle im Gesichtsfeld (Skotome) - zunächst in der
Netzhautperipherie (~20°) - sind die Folge.
,
grüner Star) und
gefährdet Netzhautdurchblutung und Sehnerven. Farb-Fehlwahrnehmungen
und Ausfälle im Gesichtsfeld (Skotome) - zunächst in der
Netzhautperipherie (~20°) - sind die Folge.  behindert.
behindert.  Parasympathimimetika regen den Ziliarmuskel zur Kontraktion an, erleichtern den Kammerwasserabfluss und senken den Augeninnendruck,
Parasympathimimetika regen den Ziliarmuskel zur Kontraktion an, erleichtern den Kammerwasserabfluss und senken den Augeninnendruck,  vgl. dort
vgl. dort
 Die Hornhaut ist das am stärksten lichtbrechende Medium des
dioptrischen Apparates (~43 dpt). Sie besteht aus Epithelschicht (~50
µm), Bowman-Membran (~10 µm), Stroma (~0,5 mm), Descemet-Membran (~10
µm) und Endothelzellschicht (~5 µm). Optimale Transparenz ergibt sich
bei einem Stromadruck von -40 mmHg (Unterdruck), der durch
Ionentransport aus der Hornhaut (zu Tränenflüssigkeit bzw.
Kammerwasser) entsteht
Die Hornhaut ist das am stärksten lichtbrechende Medium des
dioptrischen Apparates (~43 dpt). Sie besteht aus Epithelschicht (~50
µm), Bowman-Membran (~10 µm), Stroma (~0,5 mm), Descemet-Membran (~10
µm) und Endothelzellschicht (~5 µm). Optimale Transparenz ergibt sich
bei einem Stromadruck von -40 mmHg (Unterdruck), der durch
Ionentransport aus der Hornhaut (zu Tränenflüssigkeit bzw.
Kammerwasser) entsteht Auf der Hornhaut liegt ein dreischichtiger Flüssigkeitsfilm:
Tränenflüssigkeit (3-4 µ), Schleimschicht (1 µ) und Fettfilm (0,2 µ) -
darüber ein von Tarsaldrüsen (Meibom-Drüsen) produzierter öliger Film.
Tränenflüssigkeit enthält Nährstoffe, Enzyme, Immunglobuline, und ist
durchlässig für Sauerstoff. Sie wird über die Tränenwege - punctua
lacrimalia, ductus lacrimales superior und inferior, saccus lacrimalis,
ductus nasolacrimalis - in die Nase abtransportiert
Auf der Hornhaut liegt ein dreischichtiger Flüssigkeitsfilm:
Tränenflüssigkeit (3-4 µ), Schleimschicht (1 µ) und Fettfilm (0,2 µ) -
darüber ein von Tarsaldrüsen (Meibom-Drüsen) produzierter öliger Film.
Tränenflüssigkeit enthält Nährstoffe, Enzyme, Immunglobuline, und ist
durchlässig für Sauerstoff. Sie wird über die Tränenwege - punctua
lacrimalia, ductus lacrimales superior und inferior, saccus lacrimalis,
ductus nasolacrimalis - in die Nase abtransportiert Die basale Sekretion von Tränenflüssigkeit feuchtet das Auge an,
schützt und versorgt es mit Nähr- und Wirkstoffen: Salze (9 g/l NaCl), Glucose (Epithelversorgung), Aminosäuren,
Harnstoff; Mucin (Viskosität ~1,3 cP), Lipide (hydrophobe
Schutzschicht), Hormone (Prolaktin, Enkephalin, ACTH) und
Immunsubstanzen (sIgA, Lysozym, Laktoferrin, Lipocaline). Reflektorisch
angeregte Sekretion (muskarinisch-parasympathisch) spült Irritantien
fort. Tränenflüssigkeit ist fast plasmaisoton (~320 mOsm/kg) und
hat einen pH-Wert von 7,4 (wie Blut)
Die basale Sekretion von Tränenflüssigkeit feuchtet das Auge an,
schützt und versorgt es mit Nähr- und Wirkstoffen: Salze (9 g/l NaCl), Glucose (Epithelversorgung), Aminosäuren,
Harnstoff; Mucin (Viskosität ~1,3 cP), Lipide (hydrophobe
Schutzschicht), Hormone (Prolaktin, Enkephalin, ACTH) und
Immunsubstanzen (sIgA, Lysozym, Laktoferrin, Lipocaline). Reflektorisch
angeregte Sekretion (muskarinisch-parasympathisch) spült Irritantien
fort. Tränenflüssigkeit ist fast plasmaisoton (~320 mOsm/kg) und
hat einen pH-Wert von 7,4 (wie Blut) Die Dioptrie (dpt) ist der Kehrwert einer in Meter angegebenen Strecke,
hier der Brennweite. Je größer die Dioptrienzahl, desto höher das
Refraktionsvermögen: Hornhaut 43 dpt, Linse 19 dpt, Auge als
zusammengesetztes System 59 dpt. Der Brechungsindex n
eines optischen Mediums ist ein Maß für die Geschwindigkeit, mit der
das Licht durch das Medium wandert: n = Lichtgeschwindigkeit im Vakuum
/ Lichtgeschwindigkeit im Medium. Wasser (1,33) bzw. Tränenflüssigkeit
(1,34) hat einen höheren Brechungsindex als Luft (1,0).
Die Dioptrie (dpt) ist der Kehrwert einer in Meter angegebenen Strecke,
hier der Brennweite. Je größer die Dioptrienzahl, desto höher das
Refraktionsvermögen: Hornhaut 43 dpt, Linse 19 dpt, Auge als
zusammengesetztes System 59 dpt. Der Brechungsindex n
eines optischen Mediums ist ein Maß für die Geschwindigkeit, mit der
das Licht durch das Medium wandert: n = Lichtgeschwindigkeit im Vakuum
/ Lichtgeschwindigkeit im Medium. Wasser (1,33) bzw. Tränenflüssigkeit
(1,34) hat einen höheren Brechungsindex als Luft (1,0). Abbildungsfehler: Kurzwelliges Licht (blau) wird stärker gebrochen als langwelliges (rot), Randstrahlen zeigen chromatische Aberration (Farbsäume), die sich im Auge kaum bemerkbar macht. Sphärische Aberration (Hyperopie, Myopie) und Astigmatismus können optisch korrigiert werden
Abbildungsfehler: Kurzwelliges Licht (blau) wird stärker gebrochen als langwelliges (rot), Randstrahlen zeigen chromatische Aberration (Farbsäume), die sich im Auge kaum bemerkbar macht. Sphärische Aberration (Hyperopie, Myopie) und Astigmatismus können optisch korrigiert werden Ohne Akkommodation vereint das normalsichtige Auge parallel
eintreffende Lichtstrahlen auf der Netzhaut zu einem Punkt. Von nahe am
Auge liegenden Gegenstandspunkten divergieren die Lichtstrahlen;
Erhöhung der Brechkraft (Linse) ermöglicht ihre Bündelung auf der
Netzhaut zu einem Bildpunkt. Die höchstmögliche Änderung der Brechkraft
des Auges wird als Akkommodationsbreite bezeichnet, aus 1/N - 1/F
berechnet und in dptr angegeben
Ohne Akkommodation vereint das normalsichtige Auge parallel
eintreffende Lichtstrahlen auf der Netzhaut zu einem Punkt. Von nahe am
Auge liegenden Gegenstandspunkten divergieren die Lichtstrahlen;
Erhöhung der Brechkraft (Linse) ermöglicht ihre Bündelung auf der
Netzhaut zu einem Bildpunkt. Die höchstmögliche Änderung der Brechkraft
des Auges wird als Akkommodationsbreite bezeichnet, aus 1/N - 1/F
berechnet und in dptr angegeben Retinales Auflösungsvermögen: Ein Bogengrad entspricht auf der Netzhaut
300 µm Abstand. In der fovea centralis sind die Zapfen am dichtesten
gepackt - Abstand kaum 3 µm - und sie sind zu ihren Ganglienzellen 1:1
verschaltet. Sind zwei Zapfen durch einen weiteren getrennt, entspricht
das einem Abstand auf der Netzhaut von ~5 µm, entsprechend einer
Bogenminute. Der Visus (Maß für das Auflösungsvermögen) kann als
Quotient Ist-Abstand (von einer Sehprobentafel) / Soll-Abstand bestimmt
werden
Retinales Auflösungsvermögen: Ein Bogengrad entspricht auf der Netzhaut
300 µm Abstand. In der fovea centralis sind die Zapfen am dichtesten
gepackt - Abstand kaum 3 µm - und sie sind zu ihren Ganglienzellen 1:1
verschaltet. Sind zwei Zapfen durch einen weiteren getrennt, entspricht
das einem Abstand auf der Netzhaut von ~5 µm, entsprechend einer
Bogenminute. Der Visus (Maß für das Auflösungsvermögen) kann als
Quotient Ist-Abstand (von einer Sehprobentafel) / Soll-Abstand bestimmt
werden Weitsichtigkeit (Hypermetropie) ist zu geringe Brechkraft des Auges
(Auge zu kurz) und wird mit Sammellinsen (”Plus-Gläsern“) korrigiert;
Kurzsichtigkeit (Myopie) ist zu hohe Brechkraft (Auge zu lang,
Fernpunkt nahe am Auge) und wird mit Zerstreuungslinsen
("Minus-Gläsern“) korrigiert. Junge Menschen gleichen Myopie mit
Akkommodation aus, was Kopfschmerzen verursachen und Schielen
begünstigen kann. Stabsichtigkeit (Astigmatismus) bedeutet ungleiche
Refraktion in den Drehachsen und wird mit Linsen entgegengesetzter
optischer Ungleichheit (”Zylinder-Gläsern“) korrigiert
Weitsichtigkeit (Hypermetropie) ist zu geringe Brechkraft des Auges
(Auge zu kurz) und wird mit Sammellinsen (”Plus-Gläsern“) korrigiert;
Kurzsichtigkeit (Myopie) ist zu hohe Brechkraft (Auge zu lang,
Fernpunkt nahe am Auge) und wird mit Zerstreuungslinsen
("Minus-Gläsern“) korrigiert. Junge Menschen gleichen Myopie mit
Akkommodation aus, was Kopfschmerzen verursachen und Schielen
begünstigen kann. Stabsichtigkeit (Astigmatismus) bedeutet ungleiche
Refraktion in den Drehachsen und wird mit Linsen entgegengesetzter
optischer Ungleichheit (”Zylinder-Gläsern“) korrigiert Die Linse hat 19 dpt Brechkraft (bei Akkommodation mehr). Ein
linsenloses (aphakes) Auge kann keine scharfen Bilder erzeugen.
Akkommodation erhöht die Brechkraft durch (parasympathisch ausgelöste)
Kontraktion des Ziliarmuskels, bei Kindern um bis zu weitere 15
Dioptrien. Akkommodation tritt bei Blick auf nahe Gegenstände auf
(optiko-okulomotorischer Hirnnervenreflex) - die Linse wird entspannt,
nimmt ihre kugelige Eigenform an, ihre Brechkraft steigt. Blick auf
nahe Gegenstände löst Akkommodation, Miosis und Konvergenzbewegung aus.
Alterssichtigkeit (Presbyopie) bedeutet reduziertes
Akkommodationsvermögen
Die Linse hat 19 dpt Brechkraft (bei Akkommodation mehr). Ein
linsenloses (aphakes) Auge kann keine scharfen Bilder erzeugen.
Akkommodation erhöht die Brechkraft durch (parasympathisch ausgelöste)
Kontraktion des Ziliarmuskels, bei Kindern um bis zu weitere 15
Dioptrien. Akkommodation tritt bei Blick auf nahe Gegenstände auf
(optiko-okulomotorischer Hirnnervenreflex) - die Linse wird entspannt,
nimmt ihre kugelige Eigenform an, ihre Brechkraft steigt. Blick auf
nahe Gegenstände löst Akkommodation, Miosis und Konvergenzbewegung aus.
Alterssichtigkeit (Presbyopie) bedeutet reduziertes
Akkommodationsvermögen Der Pupillendurchmesser beträgt zwischen 1,5 (Miosis) und 7,5 mm
(Mydriasis) - ein ~25-facher Flächenunterschied. Acetylcholin bewirkt
Miosis (Cholinesterasehemmer verengen die Pupille), Katecholamine
(Sympathikus) erweitern sie. Wird es heller, tritt (beidseitig:
konsensuell) der Pupillenreflex auf: Edinger-Westphal-Kern → N.
oculomotorius → ganglion ciliare → m. sphincter pupillae in der Iris.
Miose ist auch Teil des Akkommodationsreflexes (corpus geniculatum
laterale → Sehrinde des Okzipitallappens → Prätektum →
Edinger-Westphal-Kern). Mydriasis wird sympathisch angeregt
(ziliospinales Zentrum C8-Th2) → truncus vasosympathicus → Kontraktion
des m. dilatator pupillae
Der Pupillendurchmesser beträgt zwischen 1,5 (Miosis) und 7,5 mm
(Mydriasis) - ein ~25-facher Flächenunterschied. Acetylcholin bewirkt
Miosis (Cholinesterasehemmer verengen die Pupille), Katecholamine
(Sympathikus) erweitern sie. Wird es heller, tritt (beidseitig:
konsensuell) der Pupillenreflex auf: Edinger-Westphal-Kern → N.
oculomotorius → ganglion ciliare → m. sphincter pupillae in der Iris.
Miose ist auch Teil des Akkommodationsreflexes (corpus geniculatum
laterale → Sehrinde des Okzipitallappens → Prätektum →
Edinger-Westphal-Kern). Mydriasis wird sympathisch angeregt
(ziliospinales Zentrum C8-Th2) → truncus vasosympathicus → Kontraktion
des m. dilatator pupillae Der Ziliarkörper bildet Kammerwasser; dazu wird Carboanhydrase
benötigt. Carboanhydrasehemmer senken den Augeninnendruck. Der Abfluss
des Kammerwassers erfolgt von der rückwärtigen zur vorderen Augenkammer
(physiologischer Pupillenwiderstand) und von dort trabekulär über den
Schlemm'schen Kanal und Sammelkanäle in episklerale Venen (80-95%)
sowie
Der Ziliarkörper bildet Kammerwasser; dazu wird Carboanhydrase
benötigt. Carboanhydrasehemmer senken den Augeninnendruck. Der Abfluss
des Kammerwassers erfolgt von der rückwärtigen zur vorderen Augenkammer
(physiologischer Pupillenwiderstand) und von dort trabekulär über den
Schlemm'schen Kanal und Sammelkanäle in episklerale Venen (80-95%)
sowie 