

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Hormone, Rezeptoren,
wirksame Konzentration
Hormone, Rezeptoren,
wirksame Konzentration
© H. Hinghofer-Szalkay
 Affinität: affinitas = Schwägerschaft
Affinität: affinitas = Schwägerschaft
Chaperone: chaperone (engl) = Anstandsdame (cappa = Kappe) - "bewahren unreife Proteine vor schädlichen Kontakten"
Dissoziation: dis-associare = trennen, scheiden
endokrin: ἔνδον = innen, κρίνειν = abscheiden
Hormon: ὁρμᾶν = antreiben, erregen
Inositolphosphat: ἰς, ἰνος = Muskel ("Muskelzucker"), φωςφορος = lichttragend
Organ, Organismus: ὄργανον = Werkzeug
Rezeptor: recipere = behalten, erlangen, aufnehmen
Die Affinität
eines Hormons gibt seine Bindungsstärke zu seinem Rezeptor an. Sie kann
als Beziehung zwischen Hormonkonzentration und Bindungsgrad
quantifiziert werden. Die Dissoziationskonstante ist reziprok zur Affinität, sie ist definiert als Quotient von Geschwindigkeitskonstanten (Dissoziation / Assoziation).
Hormone, Zytokine, Transmitter, Mediatoren binden in der Regel an Rezeptoren in der Außenmembran der Zielzelle. Rezeptorkinetik beschreibt die Gesetzmäßigkeiten, mit denen ein Hormon spezifisch gebunden und allenfalls inaktiviert wird (Endozytose, receptor downregulation). Transformationskinetik (Transduktion) untersucht
die Umsetzung des biologischen Effekts, z.B. Veränderungen von
Ionenpermeabilitäten und Second-messenger-Mechanismen,
Enzymaktivierungen etc.
Hormone, die intrazellulär an ihren Rezeptor binden, beeinflussen die Ablesung von DNA-Strecken, die als hormone-responsive elements (HREs) bezeichnet werden. Rezeptoren für Steroidhormone, Schilddrüsenhormone, Retinsäure finden sich in Zellkern und Zytoplasma.
Für die Wirkung eines Hormons
ist der langsamste Prozess der jeweiligen vorgeschalteten Wirkungskette
geschwindigkeitsbestimmend, weiters seine Verteilung im Körper
(Distribution), Metabolisierung und Ausscheidung.
|
Allgemeines und Übersicht  Hormonrezeptoren
Hormonrezeptoren  Hormonkinetik
Hormonkinetik  Affinität, Kompetition
Affinität, Kompetition

Hormon  Rezeptorkinetik
Rezeptorkinetik  Affinität, Dissoziationskonstante
Affinität, Dissoziationskonstante
 Core messages
Core messages
Signalstoffe,
die von Zellen in ihre Umgebung freigesetzt werden, um an anderen
Zellen spezifische Effekte zu erzielen, werden unterschiedlich
bezeichnet - als Mediatoren, die nur in der engeren Umgebung der "Senderzellen" wirken; Neurotransmitter, die nachgeschaltete Nervenzellen anregen oder hemmen; Zytokine, welche die Kommunikation im Immunsystem unterstützen; oder Hormone aus endokrinen Drüsen.
Was sind Hormone, wo entstehen und wie wirken sie?

Hormone
 sind Botenstoffe, die von hormonbildenden (endokrin
sind Botenstoffe, die von hormonbildenden (endokrin aktiven) Zellen in regulierter Weise in das Blut abgegeben werden und auf entfernte Zielzellen (die über entsprechende Rezeptoren verfügen) spezifische Wirkungen ausüben. Hormondrüsen
im engeren Sinne sind die Hypophyse (Hirnanhangsdrüse), Thyreoidea
(Schilddrüse), Epithelkörperchen (Nebenschilddrüsen), Nebenniere
(Adrenaldrüse) sowie die Hoden bzw. Ovarien (Geschlechtsdrüsen).
aktiven) Zellen in regulierter Weise in das Blut abgegeben werden und auf entfernte Zielzellen (die über entsprechende Rezeptoren verfügen) spezifische Wirkungen ausüben. Hormondrüsen
im engeren Sinne sind die Hypophyse (Hirnanhangsdrüse), Thyreoidea
(Schilddrüse), Epithelkörperchen (Nebenschilddrüsen), Nebenniere
(Adrenaldrüse) sowie die Hoden bzw. Ovarien (Geschlechtsdrüsen).
Dazu kommen zahlreiche weitere vereinzelt positionierte Zellen in fast
allen Geweben: Zellen der Langerhans'schen Inseln im Pankreas und
andere Zellen im Gastrointestinaltrakt; in Nieren, Herz, Fettgewebe,
Muskeln, Leber, Lunge, Haut; im Gehirn (Hypothalamus, Zirbeldrüse);
und schließlich bei schwangeren Frauen in der Plazenta (Mutterkuchen).
Zum endokrinen System zählen auch Enzyme - zellgebunden oder frei im
Kreislauf zirkulierend, sie aktivieren in der Peripherie Hormone aus
inaktiven Vorstufen. Beispielsweise wird aus Angiotensinogen (aus der
Leber) durch das Nierenenzym Renin Angiotensin I abgespalten, und aus
diesem durch das hauptsächlich aus der Lunge stammende ACE schließlich
Angiotensin II - beides erfolgt in der Blutbahn.
Endokrin aktive Gewebe und von ihnen erzeugte Hormone
|
Gebildet und sezerniert von spezialisierten Hormondrüsen
|
Hypophyse
|
Wachstumshormon, Prolaktin, ACTH, TSH, Gonadotropine
|
Schilddrüse
|
T3, T4, Calcitonin
|
Epithelkörperchen
|
Parathormon
|
Langerhans-Inseln
|
Insulin, Glukagon, Somatostatin
|
Nebenniere
|
Katecholamine, Cortisol, Aldosteron, DHEAS
|
Gonaden
|
Ovarien: Östradiol-17ß, Progesteron, Inhibin
Testes: Testosteron, AMH, Inhibin
|
| Gebildet in Organen mit nicht-endokriner Hauptfunktion |
Hypothalamus
|
Vasopressin, Oxytozin, CRH, TRH, GnRH, GHRH, Somatostatin, Dopamin
|
Zirbeldrüse
|
Melatonin
|
Herz
|
Atriales natriuretisches Peptid
|
Nieren
|
Erythropoetin
|
Fettgewebe
|
Leptin, Adipokine
|
Muskelgewebe
|
Myokine
|
Magen
|
Gastrin, Somatostatin, Ghrelin
|
Darm
|
Sekretin, Cholezystokinin, GLP, GIP
|
Leber
|
IGF-1
|
Hauptsächlich durch periphere Aktivierung gebildet
|
Lungen
|
Angiotensin II
|
Nieren
|
1,25-(OH)2-Vit- D3
|
Fettgewebe / Brustdrüsen / andere Organe
|
Östradiol-17ß
|
Leber / andere Organe
|
Testosteron
|
Haut / Prostata / andere Organe
|
5-Dihydrotestosteron (DHT)
|
Zahlreiche Organe
|
T3
|
Die Freisetzung von Hormonen unterliegt in der überwiegenden Mehrzahl der Fälle einer stabilisierenden Rückkopplung (feedback), die Hormonkonzentrationen auf bestimmte Sollwerte (set-points) hin regulieren.
Diese Sollwerte können von Umgebungseinflüssen, Stress, Alter,
Geschlecht oder sich zyklisch verändernden Faktoren (jahreszeitlich,
täglich) abhängen.
Nach der chemischen Struktur
unterscheidet man Proteine und Peptide (die meisten Hormone),
Katecholamine (Adrenalin, Noradrenalin, Dopamin), Steroidhormone
(Geschlechtshormone, Nebennierenrindenhormone, Vit. D-Hormon) und
Jodothyronine (Schilddrüsenhormone). Nach dem Wirkungsmechanismus
unterscheidet man Hormone, die an Rezeptoren der Zelloberfläche
andocken (wie Peptidhormone, Katecholamine) und solche, die in die
Zelle diffundieren und dort an intrazelluläre Hormonrezeptoren binden
(Steroidhormone, Schilddrüsenhormone).
 Zellen, welche Proteinhormone synthetisieren, haben ein stark ausgeprägtes raues endoplasmatisches Retikulum (Proteinsynthese!), während steroidproduzierende Zellen über reichlich glattes endoplasmatisches Retikulum verfügen.
Zellen, welche Proteinhormone synthetisieren, haben ein stark ausgeprägtes raues endoplasmatisches Retikulum (Proteinsynthese!), während steroidproduzierende Zellen über reichlich glattes endoplasmatisches Retikulum verfügen.
Protein- bzw. Peptidhormone müssen nach ihrer Synthese
aus der Zelle geschleust werden, indem sie in Vesikel gespeichert und
von dort exozytiert werden. Deshalb werden sie zunächst als (meist aus 100-250 Aminosäuren bestehende) Präprohormone gebildet. Ein Präprohormon verfügt an seinem N-Ende über ein 15 bis 30 Aminosäuren langes, lipophiles Signalpeptid, das es durch die Membran des endoplasmatischen Retikulums
hindurch "lotst" - gefolgt von einer Sequenz unbekannter Funktion sowie
peptid-codierenden Abschnitten. Nach Entfernung des Signalpeptids
(durch eine
Signalpeptidase) bleibt das sekretionsbereite Hormon (z.B. GH) oder
eine Vorstufe, ein Prohormon,
übrig. "Aktive Peptide" innerhalb des Prohormons sind durch Paare
basischer Aminosäuren abgegrenzt (Lys-Lys oder Lys-Arg). Hier liegen
die Angriffspunkte für trypsinähnliche Proteasen (Prohormon-Convertasen), welche die Peptide - im Golgi-Apparat oder in sekretorischen Vesikeln - aus dem Prohormon freisetzen (endoproteolytische Spaltung). Zwischen den aktiven Peptiden können Aminosäuresequenzen bisher unbekannter Funktion ('junk peptides') liegen.
Werden die Peptide vor ihrer Sekretion verändert, spricht man von posttranslationaler Modifikation. Diese erfolgt im endoplasmatischen Retikulum, im Golgi-Apparat und/oder im sekretorischen Vesikel ( s. dort). Solche Modifikationen ermöglichen Anpassung an sich ändernde Anforderungen des Zellstoffwechsels. Beispielsweise enthält Pro-Cholecystokinin
die Sequenzen für mindestens 5 CCK-ähnliche Peptide mit einer Länge von
4 bis 58 Aminosäuren, alle mit der gleichen C-terminalen
Aminosäuresequenz. Der Darm produziert vorwiegend CCK-33 (33
Aminosäuren), das Gehirn CCK-8.
s. dort). Solche Modifikationen ermöglichen Anpassung an sich ändernde Anforderungen des Zellstoffwechsels. Beispielsweise enthält Pro-Cholecystokinin
die Sequenzen für mindestens 5 CCK-ähnliche Peptide mit einer Länge von
4 bis 58 Aminosäuren, alle mit der gleichen C-terminalen
Aminosäuresequenz. Der Darm produziert vorwiegend CCK-33 (33
Aminosäuren), das Gehirn CCK-8.
Gene splicing: Peptidhormone können schon auf der Ebene von Veränderungen ihrer mRNA variiert werden. Das primäre Transkript (hnRNA, heterologous nuclear RNA) enthält (nicht-codierende) Introns und (peptid-codierende) Extrons. Das Spleißen
(Entfernung von Introns, Zusammenfügen mehrerer Extrons) kann
unterschiedliche Peptidvarianten ergeben. Beispielsweise kann aus der
Bearbeitung der hnRNA des Calcitoningens sowohl Calcitonin als auch das (ganz anders zusammengestellte) CGRP resultieren.
Die Sekretion von Protein / Peptidhormonen erfolgt nicht
kontinuierlich (wie z.B. die Freisetzung von Plasmaproteinen durch
Hepatozyten), sondern reguliert, d.h. auf spezifische Reize hin
(Reiz-Sekretions-Kopplung, stimulus-secretion coupling) - typischerweise über Depolarisierung der endokrin aktiven Zelle (Aktionspotentiale). Dabei steigt intrazelluläres [Ca++]
und andere Konzentrationen, sodass einige Speichervesikel mit der
Zellmembran fusionieren und ihren Inhalt an den Extrazellulärraum
freigeben. Dort können sich die gut wasserlöslichen
Proteo/Peptidhormone weitgehend frei gelöst bewegen (mit Ausnahme von GH und IGFs,
die stark eiweißgebunden transportiert werden). Da sie rasch durch
rezeptormediierte Endozytose und intrazellulären (lysosomalen) Abbau
wieder entfernt werden, ist ihre biologische Halbwertszeit relativ gering (GH und IGFs bleiben länger im Blut).
Manche Peptidhormone sind klein genug, um in biologisch aktiver Form und
messbarer Konzentration in anderen Körperflüssigkeiten als dem Blut - wie im Harn, Speichel oder Schweiß - aufzutauchen
(Beispiele: Die Gonadotropine LH und FSH, auch hCG, was die Durchführung von Schwangerschaftstests
mit Urinproben ermöglicht). Peptidhormone dringen auch über
Schleimhäute in den Körper ein und können daher intranasal oder
sublingual appliziert werden. Peptid/Proteohormone werden im Verdauungssystem abgebaut, eine orale Gabe bleibt daher wirkungslos.
Die folgende Tabelle gibt eine Übersicht der Charakteristika von
Peptidhormonen (bestehen aus Aminosäuren), Steroidhormonen (Abkömmlinge
des Cholesterins) und einigen Aminen (Katecholaminen,
Schilddrüsenhormonen):
Vergleich Peptide, Steroide, Amine

Modifiziert nach Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
|
|
Peptidhormone
|
Steroidhormone
|
Katecholamine
|
Schilddrüsen-
hormone
|
Synthese / Speicherung
|
Bildung im Voraus, Speicherung in Vesikeln
|
Synthese nach Bedarf aus Vorstufen
|
Speicherung in sekretorischen Vesikeln
|
Speicherung von Vorstufen im Kolloid
|
Freisetzung
|
Exozytose
|
Diffusion
|
Exozytose
|
Diffusion
|
Transport im Blut
|
In Plasma gelöst
|
Über Transportproteine
|
In Plasma gelöst
|
Über Transportproteine |
Biologische
Halbwerts-
zeit
|
kurz
|
lang *
|
kurz
|
lang
|
Rezeptoren wo?
|
Zellmembran
|
Zytoplasma / Zellkern
|
Zellmembran
|
Zellkern
|
Reaktion auf Bindung an Rezeptor
|
Aktivierung von second messengers, evt. Genen
|
Genaktivierung /
evt. nongenomische Wirkungen
|
Aktivierung von second messenger- Systemen
|
Genaktivierung
|
Antwort des Zielsystems
|
Modifikation vorhandener Proteine / Induktion von Proteinsynthese
|
Induktion von Proteinsynthese |
Modifikation vorhandener Proteine |
Induktion von Proteinsynthese |
Beispiele
|
Insulin
Parathormon
|
Cortisol
Östrogene
Testosteron
|
Adrenalin
Noradrenalin
|
Thyroxin (T4)
|
* Ausnahme Aldosteron: Kurze Halbwertszeit (ca. 20 Minuten) wegen geringer Bindung an Plasmaproteine
Hormonrezeptoren
 Über Rezeptortypen s. auch dort
Über Rezeptortypen s. auch dort
Ist ein Hormon in den Extrazellulärraum freigesetzt worden und gelangt in den Kreislauf, dann ergibt sich aus
seiner Verteilung im Körper, der Intensität und dem Zeitverlauf (Kinetik) der Rezeptorbindung,
Wiederaufnahme in die "sendende" Zelle
(reuptake), Abtransport, Abbau und
Ausscheidung ein bestimmter zeitlicher Verlauf des Auftretens und
Abklingens seiner Effekte.
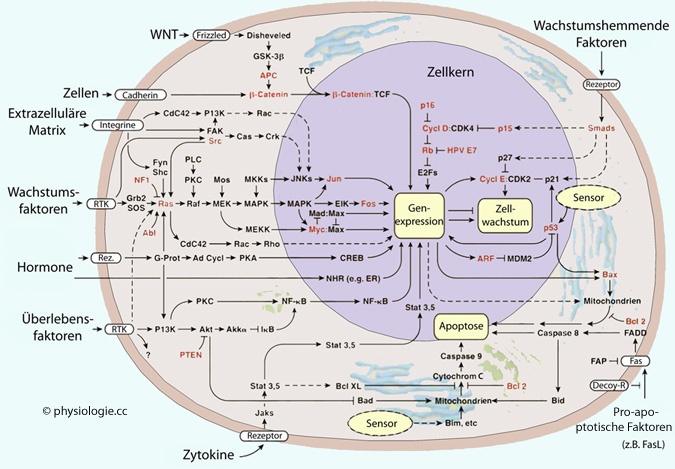

Abbildung:
Wege der Signaltransduktion in das Zellinnere
Nach einer Vorlage bei migration.wordpress.com/2007
Zellen reagieren auf extrazelluläre Botenstoffe mittels unterschiedlicher Signaltransduktionswege. Die Wnt-Genfamilie codiert Signalproteine
 Über Apoptose s. dort, Extrazelluläre Matrix s. dort, Genexpression s. dort, Wachstumsfaktoren s. dort, Zytokine s. dort
Über Apoptose s. dort, Extrazelluläre Matrix s. dort, Genexpression s. dort, Wachstumsfaktoren s. dort, Zytokine s. dort
 Um wirksam werden zu können, müssen Hormone an Rezeptormoleküle binden - an der Zellmembran der Zielzelle oder intrazellulär. Dabei fungieren sie als Liganden für den Rezeptor. Stoffe, welche ebenfalls an den Rezeptor binden und ähnliche Wirkung wie das Hormon ausüben, nennt man Agonisten; solche, welche die Hormonwirkung behindern (z.B. indem sie binden, ohne eine Folgereaktion auszulösen), Antagonisten.
Konkurrieren Liganden um die Bindung am Rezeptor, können sie - indem
sie Bindungsstellen besetzen - die Wirkung des jeweils anderen
wechselseitig beeinflussen.
Um wirksam werden zu können, müssen Hormone an Rezeptormoleküle binden - an der Zellmembran der Zielzelle oder intrazellulär. Dabei fungieren sie als Liganden für den Rezeptor. Stoffe, welche ebenfalls an den Rezeptor binden und ähnliche Wirkung wie das Hormon ausüben, nennt man Agonisten; solche, welche die Hormonwirkung behindern (z.B. indem sie binden, ohne eine Folgereaktion auszulösen), Antagonisten.
Konkurrieren Liganden um die Bindung am Rezeptor, können sie - indem
sie Bindungsstellen besetzen - die Wirkung des jeweils anderen
wechselseitig beeinflussen.
Die Konzentration eines Hormons im Blut
(dieser Wert ist labormedizinisch erfassbar) sagt noch nicht aus, ob
oder wie stark es wirkt. Es muss aus dem Kreislauf hinaus an die
Zielzellen gelangen, und an diesen müssen spezifische Rezeptoren
 verfügbar sein, damit das Hormon - über Bindung an Rezeptoren und
Aktivierung nachfolgender Mechanismen - seine Wirkung entfalten kann.
verfügbar sein, damit das Hormon - über Bindung an Rezeptoren und
Aktivierung nachfolgender Mechanismen - seine Wirkung entfalten kann.
Einfluss auf Enzymaktivitäten:
Ist das Signal eines wasserlöslichen Hormons - das an seinen Rezeptor
in der Zellmembran gekoppelt hat - durch die Membran gedrungen (d.h.,
hat es am Rezeptor entsprechende Konformationsänderung
hervorgerufen und z.B. G-Proteine aktiviert), dann folgen enzymatische
Schritte in der Zelle, z.B. werden Proteine oder Lipide durch Kinasen (ATP-abhängig) phosphoryliert (dadurch wird das betreffende Molekül stärker negativ geladen) oder durch Phosphatasen dephosphoryliert.
Was das bewirkt, hängt vom jeweiligen Stoffwechselweg ab: Phosphorylierung (an Serin, Threonin oder Tyrosin) kann Enzyme aktivieren oder inaktivieren,
z.B. in Abhängigkeit davon, ob der Vorgang anabol oder katabol ist.
Proteine verfügen oft über mehrere Stellen, an denen sie phosphoryliert
werden können. Phosphorylierung kann den Abbau eines Proteins (durch Ubiquitinierung und proteasomalen Abbau) beschleunigen. Auch kann Phosphorylierung die Position eines Proteins in der Zelle beeinflussen, z.B. wenn phosphorylierte Transkriptionsfaktoren eher im Zytoplasma verbleiben bzw. aus dem Zellkern auswandern.
Die Aktivität extranukleärer Proteine kann auch über den Grad ihrer Acetylierung reguliert werden: Acetyltransferasen fördern, Deacetylasen reduzieren sie. Histone
und andere Chromatinproteine im Zellkern können durch Acetylierung und
Phosphorylierung so beeinflusst werden, dass sich die Ablesbarkeit von DNA-Strecken verändert.
Unter Kinetik des Hormons
versteht man dabei die Vorgänge, die nach seiner Freisetzung zu einer
bestimmten örtlich-zeitlichen Verteilungsdynamik in den diversen
Verteilungsräumen (compartments) des Körpers führen.
Als Biophase
bezeichnet man dabei den Raum, von dem aus das Hormon direkt mit seinen
Bindungsstellen reagieren kann.


Abbildung: Schlüssel-Schloss-Prinzip
Der Signalstoff bindet spezifisch an seinen Rezeptor
 Zu Rezeptoren s. dort
Zu Rezeptoren s. dort

Die
Rezeptorkinetik beschreibt
die Gesetzmäßigkeiten, mit denen das Hormon an bestimmten spezifischen
Orten
gebunden und gegebenenfalls inaktiviert wird (hier spielt u.a. die
Endozytose hormonbeladener Rezeptoren mit intrazellulären
Folgevorgängen wie Dissoziation

/ Abbau eine Rolle).
Transformationskinetik beschäftigt sich mit der
Umsetzung des biologischen
Effekts. Dieser auch als
Transduktion bezeichnete Vorgang umfasst z.B.
Veränderungen von Ionenpermeabilitäten und second-messenger- Mechanismen
(Enzymaktivierungen etc).
Oft wurden die Rezeptoren, über die Signalstoffe (Hormone, Transmitter,
Zytokine, Mediatoren) an ihren Zielzellen wirken, erst viele Jahre
später entdeckt und analysiert als die Signalstoffe selbst. Manchmal
ist es auch umgekehrt: Dann werden Rezeptoren beschrieben, für die noch
kein passender Wirkstoff bekannt ist
("orphan receptors"). Es können auch Rezeptoren mutiert sein und funktionslos bleiben (man sagt dann, sie werden durch "Pseudogene" codiert).

 Abbildung: Die Rezeptorausstattung der Zelle bestimmt darüber, auf welche Hormone sie anspricht
Abbildung: Die Rezeptorausstattung der Zelle bestimmt darüber, auf welche Hormone sie anspricht
 Beispiel 1: Der aktivierte Rezeptor verändert die Ionen-Durchlässigkeit von
Permeasen oder aktiviert Membran-G-Proteine. Dies bewirkt die
Bildung eines zweiten Botenstoffs, entweder zyklisches
Adenosin-Monophosphat (cAMP) oder Diacylglycerin (DAG) plus
Inositoltriphosphat (IP3).
Beispiel 1: Der aktivierte Rezeptor verändert die Ionen-Durchlässigkeit von
Permeasen oder aktiviert Membran-G-Proteine. Dies bewirkt die
Bildung eines zweiten Botenstoffs, entweder zyklisches
Adenosin-Monophosphat (cAMP) oder Diacylglycerin (DAG) plus
Inositoltriphosphat (IP3).  cAMP wird durch das Enzym Adenylylcyclase
aus ATP gebildet, DAG und IP3 durch Phospholipase C aus Molekülen der
Zellmembran (
cAMP wird durch das Enzym Adenylylcyclase
aus ATP gebildet, DAG und IP3 durch Phospholipase C aus Molekülen der
Zellmembran ( s. dort).
s. dort).
Schließlich werden Proteinkinasen in der Zelle aktiviert
(und Ca++ aus dem endoplasmatischen Retikulum freigesetzt), diese vermitteln die Hormonwirkung. Ca++-Ionen können
auch über aktivierte Kanäle in der Zellmembran aus dem
Extrazellulärraum einströmen.
In beiden Fällen bindet Calcium an
intrazelluläre Vermittlungsmoleküle (z.B. Calmodulin), welche enzymatische Aktivierung vermitteln, wie
 Ca++-abhängige Kinase,
Ca++-abhängige Kinase,
 Adenylylcyclase,
Adenylylcyclase,
 Myosinleichtkettenkinase,
Myosinleichtkettenkinase,
 die Phosphatase Calcineurin oder
die Phosphatase Calcineurin oder
 endotheliale Stickstoffmonoxid-Synthase (eNOS).
endotheliale Stickstoffmonoxid-Synthase (eNOS).
Dieser Mechanismus wird von der
Großzahl der Hormone, insbesondere von Peptid- und Proteohormonen,
benützt.
 Beispiel 2:
Schilddrüsenhormone wirken über Rezeptoren im Zellkern, Steroidhormonrezeptoren liegen schon im Zytoplasma vor. Steroid- und
Schilddrüsenhormone koppeln sich von ihrem extrazellulären Transportermolekül
ab, durchdringen die
Zellmembran, gelangen in das Zytoplasma
(s. dort) und anschließend in den Zellkern. Hier binden sie an chromatinständige
Rezeptoren und initiieren so Transkription,
Proteinsynthese und Hormonwirkung.
Beispiel 2:
Schilddrüsenhormone wirken über Rezeptoren im Zellkern, Steroidhormonrezeptoren liegen schon im Zytoplasma vor. Steroid- und
Schilddrüsenhormone koppeln sich von ihrem extrazellulären Transportermolekül
ab, durchdringen die
Zellmembran, gelangen in das Zytoplasma
(s. dort) und anschließend in den Zellkern. Hier binden sie an chromatinständige
Rezeptoren und initiieren so Transkription,
Proteinsynthese und Hormonwirkung.
DNA-Sequenzen, an die der Hormonkomplex bindet, heißen hormone-responsive elements
(HREs). Das zu beeinflussende Gen liegt weiter "stromabwärts" (meist
einige 100 Basenpaare) und ist üblicherweise ein Schlüssenenzym im
betreffenden Stoffwechsel. So wird die Menge des jeweiligen Enzyms in
der Zelle erhöht (Induktion) oder erniedrigt (Repression).
Neusynthese von Proteinen braucht einige Zeit, um zu greifen, lipophile
Hormone wirken daher meist verzögert und eignen sich vor allem für eher
langfristige Anpassungen.
Affinität und Kompetition
Affinitäten und Gleichgewichtskonstanten spielen überall dort eine Rolle, wo es um spezifische Anlagerung geht - bei der Bindung von Mediatoren, Transmittern oder Hormonen an
ihre Rezeptoren, oder in der Immunologie (Antigen-Antikörper-Reaktion).
Zentrale Bedeutung im gegebenen Zusammenhang hat die Affinität zwischen den Reaktionspartnern. Diese läßt sich über die Kinetik der Reaktionen quantifizieren:
 Als Affinität
Als Affinität bezeichnet man die Stärke der Bindung zwischen einer singulären
Bindungsstelle (z.B. eines Rezeptors oder Antikörpers) und einem
Liganden (z.B. Hormon oder Antigen) - je höher
die Affinität, desto eher und intensiver erfolgt die Bindung. Die Affinität ist quantifizierbar über die
betreffende Dissoziationskonstante kd:
Das ist die molare Konzentration eines Liganden, die
erforderlich ist, um die Hälfte der vorhandenen Bindungspartner zu
besetzen. Je höher die für eine Bindung benötigte Konzentration eines
Bindungspartners, desto geringer ist die Bindungsaffinität.
bezeichnet man die Stärke der Bindung zwischen einer singulären
Bindungsstelle (z.B. eines Rezeptors oder Antikörpers) und einem
Liganden (z.B. Hormon oder Antigen) - je höher
die Affinität, desto eher und intensiver erfolgt die Bindung. Die Affinität ist quantifizierbar über die
betreffende Dissoziationskonstante kd:
Das ist die molare Konzentration eines Liganden, die
erforderlich ist, um die Hälfte der vorhandenen Bindungspartner zu
besetzen. Je höher die für eine Bindung benötigte Konzentration eines
Bindungspartners, desto geringer ist die Bindungsaffinität.
 Je niedriger der kd-Wert,
desto größer ist die Bindungsstärke (Affinität) - z.B. zwischen einem
Hormon und seinem Rezeptor - und umgekehrt. Beispiel: Hormon A hat für
ein bestimmtes zelluläres Rezeptorprotein einen kd-Wert von 0,6, Hormon B einen kd-Wert von 4,3. Hormon A hat die größere Bindungsstärke.
Je niedriger der kd-Wert,
desto größer ist die Bindungsstärke (Affinität) - z.B. zwischen einem
Hormon und seinem Rezeptor - und umgekehrt. Beispiel: Hormon A hat für
ein bestimmtes zelluläres Rezeptorprotein einen kd-Wert von 0,6, Hormon B einen kd-Wert von 4,3. Hormon A hat die größere Bindungsstärke.
Beispiel: Antikörper, die im Rahmen einer primären Immunantwort entstehen, haben meist einen kd-Wert zwischen 10-6 bis 10-9 M. Nach wiederholter Reizung der betreffenden antigenspezifischen Zellen kann [kd] bis zu Werten von etwa 10-11 M zunehmen (Affinitätsreifung: Zunahme der Affinität, z.B. der Stärke der Epitopbindung von Immunrezeptoren im Rahmen einer sekundären Immunantwort).
Bei einer Reaktion der Stoffe A und B entsteht AB; die Reaktion A + B → AB bezeichnet man als Assoziation, die Reaktion AB → A + B als Dissoziation. [A], [B] und [AB] sind die Konzentrationen von A, B und AB.
Die Reaktionsgeschwindigkeit v einer Reaktion ist proportional zur Konzentration der Stoffe und der Geschwindigkeitskonstante k:
v = k . [A] . [B]
Eine Geschwindigkeitskonstante kennzeichnet also die Geschwindigkeit einer Reaktion;
 die Assoziationsgeschwindigkeitskonstante (ka) die der Assoziation,
die Assoziationsgeschwindigkeitskonstante (ka) die der Assoziation,
 die Dissoziationsgeschwindigkeitskonstante (kd) die der Dissoziation.
die Dissoziationsgeschwindigkeitskonstante (kd) die der Dissoziation.
Eine Gleichgewichtskonstante K ist nach dem Massenwirkungsgesetz gegeben aus dem
Verhältnis der Konzentrationen der Reaktionspartner und des
Reaktionsprodukts. Man kann sie sowohl für die Assoziations- als auch
für die Dissoziationsreaktion angeben, oder als das Verhältnis der
gegenläufigen Geschwindigkeitskonstanten: Die Assoziationskonstante ist definiert als
KA = [AB] / ([A] . [B]) = ka / kd
und die Dissoziationskonstante als
KD = ([A] . [B]) / [AB] = kd / ka
An dem
Punkt, an dem ein bestimmtes Verhältnis der
Reaktionspartner (Hormon - Ligand, Antigen - Antikörper u.ä.) keine
Netto-Reaktion mehr ergibt
(Bindungsrate = Lösungsrate), besteht ein Reaktionsgleichgewicht, d.h.
die Konzentrationen der Reaktionspartner ändern sich nicht (gleiche
Reaktionsgeschwindigkeit in beide Richtungen).
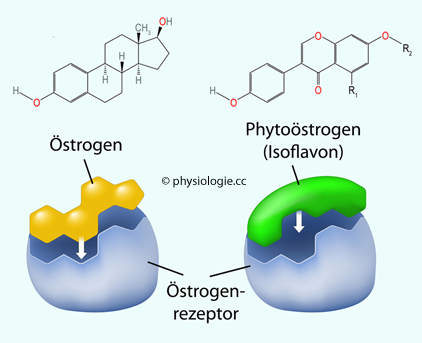
 Abbildung: Isoflavon - Agonist oder Antagonist?
Abbildung: Isoflavon - Agonist oder Antagonist?
Nach einer Vorlage bei foodrevolution.org
Stoffe,
die an Hormonrezeptoren binden, können verschiedene Wirkungen haben:
Agonisten üben einen "klassischen" Effekt aus (wie das "eigentliche"
Hormon, z.B. Östrogen), Antagonisten verhindern diesen Effekt
kompetitiv oder nichtkompetitiv (s. Text). Die Grenze zwischen
agonistischer und antagonistischer Wirkung kann unscharf sein.
So binden Isoflavone (z.B. aus Sojabohnen) - die eine ähnliche Form wie
Östrogene haben, aber keine Steroide sind - an Östrogenrezeptoren,
aktivieren diese nur schwach, werden aber als Phytoöstrogene
("Pflanzenöstrogene") bezeichnet
 Kompetition und Verdrängung. Oft sind Rezeptormoleküle mit mehreren Signalstoffen gleichzeitig konfrontiert, die an ihn (orthosterisch,
also an einen definierten Ort am Molekül) binden können. Da die
Anlagerung der einzelnen Hormon-, Transmitter-, Mediatormoleküle an den
Rezeptor reversibel ist und meist nur kurz dauert, findet ein ständiger
Wechsel der Bindungspartner statt. Bei gegebener Rezeptorzahl
entscheidet bei Anwesenheit berschiedener Liganden (z.B. eines Agonisten
und eines Antagonisten) einerseits die jeweilige Affinität,
andererseits die jeweilige Konzentration der Signalstoffe, wie hoch die
Wahrscheinlichkeit ist, dass an einem Rezeptormolekül gerade ein
bestimmter Signalstoff gebunden ist (occupancy: Rezeptorbesetzung).
Kompetition und Verdrängung. Oft sind Rezeptormoleküle mit mehreren Signalstoffen gleichzeitig konfrontiert, die an ihn (orthosterisch,
also an einen definierten Ort am Molekül) binden können. Da die
Anlagerung der einzelnen Hormon-, Transmitter-, Mediatormoleküle an den
Rezeptor reversibel ist und meist nur kurz dauert, findet ein ständiger
Wechsel der Bindungspartner statt. Bei gegebener Rezeptorzahl
entscheidet bei Anwesenheit berschiedener Liganden (z.B. eines Agonisten
und eines Antagonisten) einerseits die jeweilige Affinität,
andererseits die jeweilige Konzentration der Signalstoffe, wie hoch die
Wahrscheinlichkeit ist, dass an einem Rezeptormolekül gerade ein
bestimmter Signalstoff gebunden ist (occupancy: Rezeptorbesetzung).
Diese wechselseitige Verdrängung der Signalstoffe am orthosterischen ("klassischen") Bindungsort des Rezeptors nennt man kompetitiven Antagonismus. Antagonisten können auch an anderen Bindungsorten des Rezeptormoleküls (allosterisch) andocken und auf diese Weise die Signalübertragung hemmen, man nennt sie dann nichtkompetitive Antagonisten. Jeder molekulare Bindungsort kann zu einem gegebenen Zeitpunkt jeweils nur von einem Bindungspartner besetzt werden, nicht von mehreren gleichzeitig.
 Die
Wahrscheinlichkeit der (reversiblen) Bindung eines Antagonisten an
Rezeptormoleküle kann durch Erhöhung der Konzentration von Agonisten
verringert und damit die Blockade der Rezeptorwirkung durch den
Antagonisten gesenkt (die intrinsische Aktivität des Agonisten erhöht)
werden. Das Prinzip der Kompetition gilt allgemein, Kombinationen
physiologischer und/oder pharmakologischer Agonisten / Antagonisten
können so um Bindungsorte an zellulären Rezeptoren konkurrieren.
Die
Wahrscheinlichkeit der (reversiblen) Bindung eines Antagonisten an
Rezeptormoleküle kann durch Erhöhung der Konzentration von Agonisten
verringert und damit die Blockade der Rezeptorwirkung durch den
Antagonisten gesenkt (die intrinsische Aktivität des Agonisten erhöht)
werden. Das Prinzip der Kompetition gilt allgemein, Kombinationen
physiologischer und/oder pharmakologischer Agonisten / Antagonisten
können so um Bindungsorte an zellulären Rezeptoren konkurrieren.
Nachdem ein Hormon an seinen Rezeptor gebunden hat, muss der biologische Effekt in der Zelle - seine intrinsische Aktivität - ausgelöst werden; diese Umsetzung wird als Transduktion oder
Transformation bezeichnet und die entsprechende Kinetik als
Transformationskinetik. Je nach involvierten Vorgängen kann dies rasch
(z.B. Membranpotentialänderung) oder langsam erfolgen (z.B.
Genaktivierung → Proteinsynthese).
 Der jeweils langsamste Prozess der betreffenden Wirkungskette ist für das Auftreten der Hormonwirkung
geschwindigkeitsbestimmend.
Der jeweils langsamste Prozess der betreffenden Wirkungskette ist für das Auftreten der Hormonwirkung
geschwindigkeitsbestimmend.
Insgesamt spielen für die Wirksamkeit von Hormonen und deren
Zeitverlauf auch andere Faktoren eine Rolle, wie
 Verteilung im Körper (Distribution),
Verteilung im Körper (Distribution),
 Umwandlung und Verstoffwechselung (Metabolisierung) und
Umwandlung und Verstoffwechselung (Metabolisierung) und
 Ausscheidung (Exkretion).
Ausscheidung (Exkretion).
Zur Quantifizierung der zeitabhängigen Konzentrations- und
Wirkungsprofile können mathematische Modelle herangezogen werden, in
denen der kompartimentelle Aufbau des Organismus  und diverse Kenngrößen
für Sekretion, Distribution, Kinetik, Metabolisierung und Ausscheidung
Berücksichtigung finden. Solche Modelle stehen insbesondere als
Instrument der Pharmakokinetik zur Verfügung.
und diverse Kenngrößen
für Sekretion, Distribution, Kinetik, Metabolisierung und Ausscheidung
Berücksichtigung finden. Solche Modelle stehen insbesondere als
Instrument der Pharmakokinetik zur Verfügung.


 Hormone werden
kontrolliert gebildet, gespeichert, freigesetzt und abgebaut /
ausgeschieden. Dabei ist ihre Sekretion an die aktuellen Anforderungen
geknüpft (Steuerung, Rückkopplung). Die Sollwerte hängen von Alter,
Geschlecht, Umstands- (Umgebungseinflüsse) und
zeitabhängigen Faktoren (zirkadian, jahreszeitlich) ab. Die
meisten Hormone sind Proteine / Peptide; sie werden synthetisiert
(Translation), modifiziert, gespeichert (Vesikel) und freigesetzt (Exozytose) -
letzteres Ca++-getriggert.
Andere Hormone werden aus Vorgängermolekülen enzymatisch hergestellt, z.B. biogene Amine, die
ebenfalls in Vesikeln gespeichert werden; Schilddrüsenhormone
extrazellulär, im Kolloid der Schilddrüsenfollikel. Kleine Hormonmoleküle (inklusive Peptidhormone)
gelangen in messbarer Konzentration in den Harn (z.B.
Schwangerschaftstest für hCG) Hormone werden
kontrolliert gebildet, gespeichert, freigesetzt und abgebaut /
ausgeschieden. Dabei ist ihre Sekretion an die aktuellen Anforderungen
geknüpft (Steuerung, Rückkopplung). Die Sollwerte hängen von Alter,
Geschlecht, Umstands- (Umgebungseinflüsse) und
zeitabhängigen Faktoren (zirkadian, jahreszeitlich) ab. Die
meisten Hormone sind Proteine / Peptide; sie werden synthetisiert
(Translation), modifiziert, gespeichert (Vesikel) und freigesetzt (Exozytose) -
letzteres Ca++-getriggert.
Andere Hormone werden aus Vorgängermolekülen enzymatisch hergestellt, z.B. biogene Amine, die
ebenfalls in Vesikeln gespeichert werden; Schilddrüsenhormone
extrazellulär, im Kolloid der Schilddrüsenfollikel. Kleine Hormonmoleküle (inklusive Peptidhormone)
gelangen in messbarer Konzentration in den Harn (z.B.
Schwangerschaftstest für hCG)
 Hormone müssen an
Rezeptoren binden, um wirken zu können. Hormonrezeptoren sind für eine Hormonwirkung
unerlässlich. Agonisten binden ebenfalls an den Rezeptor und wirken
hormonähnlich, Antagonisten behindern die
Hormonwirkung. Hormone wirken
an Rezeptoren der Zellmembran, oder direkt im Zellinneren, dann meist
durch Eingriff in die Verwertung der Erbinformation. Hydrophile Hormone binden an membranständige Rezeptoren und
bewirken z.B.
Phosphorylierung von Enzymen. Histone und andere
Chromatinproteine im Zellkern können durch Acetylierung,
Phosphorylierung u.a. so beeinflusst werden, dass sich die Ablesbarkeit von DNA-Strecken verändert Hormone müssen an
Rezeptoren binden, um wirken zu können. Hormonrezeptoren sind für eine Hormonwirkung
unerlässlich. Agonisten binden ebenfalls an den Rezeptor und wirken
hormonähnlich, Antagonisten behindern die
Hormonwirkung. Hormone wirken
an Rezeptoren der Zellmembran, oder direkt im Zellinneren, dann meist
durch Eingriff in die Verwertung der Erbinformation. Hydrophile Hormone binden an membranständige Rezeptoren und
bewirken z.B.
Phosphorylierung von Enzymen. Histone und andere
Chromatinproteine im Zellkern können durch Acetylierung,
Phosphorylierung u.a. so beeinflusst werden, dass sich die Ablesbarkeit von DNA-Strecken verändert
 Ca++ kann Hormonwirkungen vermitteln - es wird auf Reizung hin aus dem endoplasmatischen Retikulum freigesetzt oder dringt über die Zellmembran aus dem Extrazellulärraum ein (Calciumkanäle).
Es aktiviert z.B. Kinasen, Adenylylcyclase, Myosinleichtkettenkinase,
Phosphatasen, endotheliale Stickstoffmonoxid-Synthase (eNOS). Dieser
Mechanismus wird von der Großzahl der Hormone, insbesondere von Peptid-
und Proteohormonen, benützt Ca++ kann Hormonwirkungen vermitteln - es wird auf Reizung hin aus dem endoplasmatischen Retikulum freigesetzt oder dringt über die Zellmembran aus dem Extrazellulärraum ein (Calciumkanäle).
Es aktiviert z.B. Kinasen, Adenylylcyclase, Myosinleichtkettenkinase,
Phosphatasen, endotheliale Stickstoffmonoxid-Synthase (eNOS). Dieser
Mechanismus wird von der Großzahl der Hormone, insbesondere von Peptid-
und Proteohormonen, benützt
 Steroid- und
Schilddrüsenhormone dissoziieren am Zielort vom Transportermolekül,
durchdringen die Zellmembran, binden im Zytoplasma an Trägerproteine
und beeinflussen die Transkription von Zielgenen. Hormonresponsible
Elemente sind DNA-Sequenzen, an die der Hormonkomplex bindet und die
Expression bestimmter Schlüssenenzyme beeinflusst. So wird die Menge
der jeweiligen Enzyme erhöht (Induktion) oder erniedrigt (Repression);
solche Hormonwirkungen erfolgen verzögert. da die Neusynthese von Proteinen einige Zeit benötigt Steroid- und
Schilddrüsenhormone dissoziieren am Zielort vom Transportermolekül,
durchdringen die Zellmembran, binden im Zytoplasma an Trägerproteine
und beeinflussen die Transkription von Zielgenen. Hormonresponsible
Elemente sind DNA-Sequenzen, an die der Hormonkomplex bindet und die
Expression bestimmter Schlüssenenzyme beeinflusst. So wird die Menge
der jeweiligen Enzyme erhöht (Induktion) oder erniedrigt (Repression);
solche Hormonwirkungen erfolgen verzögert. da die Neusynthese von Proteinen einige Zeit benötigt
 Die Gleichgewichtskonstante
eines Hormons bestimmt den Punkt, an dem ein bestimmtes Verhältnis der
Reaktionspartner (z.B. Hormon - Rezeptor, Antikörper - Antigen) keine Netto-Reaktion mehr ergibt
(Bindungsrate = Lösungsrate). Die Affinität gibt
die Beziehung Hormonkonzentration / Rezeptorbindungswahrscheinlichkeit
an; der reziproke Wert zur Assoziationskonstanten ist die Dissoziationskonstante (diese wird häufig zur Quantifizierung der Affinität angegeben). Transduktion (Transformation) betrifft den biologischen Effekt nach der Rezeptorbindung (Transformationskinetik) - das kann rasch (z.B. Hormonbindung → Membranpotentialänderung) oder langsam erfolgen (z.B. Genaktivierung → Proteinsynthese). Der jeweils langsamste Prozess der Wirkungskette ist für das Auftreten der Hormonwirkung geschwindigkeitsbestimmend Die Gleichgewichtskonstante
eines Hormons bestimmt den Punkt, an dem ein bestimmtes Verhältnis der
Reaktionspartner (z.B. Hormon - Rezeptor, Antikörper - Antigen) keine Netto-Reaktion mehr ergibt
(Bindungsrate = Lösungsrate). Die Affinität gibt
die Beziehung Hormonkonzentration / Rezeptorbindungswahrscheinlichkeit
an; der reziproke Wert zur Assoziationskonstanten ist die Dissoziationskonstante (diese wird häufig zur Quantifizierung der Affinität angegeben). Transduktion (Transformation) betrifft den biologischen Effekt nach der Rezeptorbindung (Transformationskinetik) - das kann rasch (z.B. Hormonbindung → Membranpotentialänderung) oder langsam erfolgen (z.B. Genaktivierung → Proteinsynthese). Der jeweils langsamste Prozess der Wirkungskette ist für das Auftreten der Hormonwirkung geschwindigkeitsbestimmend
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Hormone, Rezeptoren,
wirksame Konzentration
Hormone, Rezeptoren,
wirksame Konzentration
 Affinität: affinitas = Schwägerschaft
Affinität: affinitas = Schwägerschaft Hormonrezeptoren
Hormonrezeptoren  Hormonkinetik
Hormonkinetik  Affinität, Kompetition
Affinität, Kompetition
 Rezeptorkinetik
Rezeptorkinetik  Affinität, Dissoziationskonstante
Affinität, Dissoziationskonstante
 Hormone
Hormone  sind Botenstoffe, die von hormonbildenden (endokrin
sind Botenstoffe, die von hormonbildenden (endokrin aktiven) Zellen in regulierter Weise in das Blut abgegeben werden und auf entfernte Zielzellen (die über entsprechende Rezeptoren verfügen) spezifische Wirkungen ausüben. Hormondrüsen
im engeren Sinne sind die Hypophyse (Hirnanhangsdrüse), Thyreoidea
(Schilddrüse), Epithelkörperchen (Nebenschilddrüsen), Nebenniere
(Adrenaldrüse) sowie die Hoden bzw. Ovarien (Geschlechtsdrüsen).
aktiven) Zellen in regulierter Weise in das Blut abgegeben werden und auf entfernte Zielzellen (die über entsprechende Rezeptoren verfügen) spezifische Wirkungen ausüben. Hormondrüsen
im engeren Sinne sind die Hypophyse (Hirnanhangsdrüse), Thyreoidea
(Schilddrüse), Epithelkörperchen (Nebenschilddrüsen), Nebenniere
(Adrenaldrüse) sowie die Hoden bzw. Ovarien (Geschlechtsdrüsen).  Zellen, welche Proteinhormone synthetisieren, haben ein stark ausgeprägtes raues endoplasmatisches Retikulum (Proteinsynthese!), während steroidproduzierende Zellen über reichlich glattes endoplasmatisches Retikulum verfügen.
Zellen, welche Proteinhormone synthetisieren, haben ein stark ausgeprägtes raues endoplasmatisches Retikulum (Proteinsynthese!), während steroidproduzierende Zellen über reichlich glattes endoplasmatisches Retikulum verfügen. s. dort). Solche Modifikationen ermöglichen Anpassung an sich ändernde Anforderungen des Zellstoffwechsels. Beispielsweise enthält Pro-Cholecystokinin
die Sequenzen für mindestens 5 CCK-ähnliche Peptide mit einer Länge von
4 bis 58 Aminosäuren, alle mit der gleichen C-terminalen
Aminosäuresequenz. Der Darm produziert vorwiegend CCK-33 (33
Aminosäuren), das Gehirn CCK-8.
s. dort). Solche Modifikationen ermöglichen Anpassung an sich ändernde Anforderungen des Zellstoffwechsels. Beispielsweise enthält Pro-Cholecystokinin
die Sequenzen für mindestens 5 CCK-ähnliche Peptide mit einer Länge von
4 bis 58 Aminosäuren, alle mit der gleichen C-terminalen
Aminosäuresequenz. Der Darm produziert vorwiegend CCK-33 (33
Aminosäuren), das Gehirn CCK-8.
 Über Rezeptortypen s. auch dort
Über Rezeptortypen s. auch dort
 Abbildung:
Wege der Signaltransduktion in das Zellinnere
Abbildung:
Wege der Signaltransduktion in das Zellinnere Über Apoptose s. dort, Extrazelluläre Matrix s. dort, Genexpression s. dort, Wachstumsfaktoren s. dort, Zytokine s. dort
Über Apoptose s. dort, Extrazelluläre Matrix s. dort, Genexpression s. dort, Wachstumsfaktoren s. dort, Zytokine s. dort 
 verfügbar sein, damit das Hormon - über Bindung an Rezeptoren und
Aktivierung nachfolgender Mechanismen - seine Wirkung entfalten kann.
verfügbar sein, damit das Hormon - über Bindung an Rezeptoren und
Aktivierung nachfolgender Mechanismen - seine Wirkung entfalten kann. 
 Abbildung: Schlüssel-Schloss-Prinzip
Abbildung: Schlüssel-Schloss-Prinzip Zu Rezeptoren s. dort
Zu Rezeptoren s. dort Die Rezeptorkinetik beschreibt
die Gesetzmäßigkeiten, mit denen das Hormon an bestimmten spezifischen
Orten gebunden und gegebenenfalls inaktiviert wird (hier spielt u.a. die
Endozytose hormonbeladener Rezeptoren mit intrazellulären
Folgevorgängen wie Dissoziation
Die Rezeptorkinetik beschreibt
die Gesetzmäßigkeiten, mit denen das Hormon an bestimmten spezifischen
Orten gebunden und gegebenenfalls inaktiviert wird (hier spielt u.a. die
Endozytose hormonbeladener Rezeptoren mit intrazellulären
Folgevorgängen wie Dissoziation  / Abbau eine Rolle). Transformationskinetik beschäftigt sich mit der Umsetzung des biologischen
Effekts. Dieser auch als Transduktion bezeichnete Vorgang umfasst z.B.
Veränderungen von Ionenpermeabilitäten und second-messenger- Mechanismen
(Enzymaktivierungen etc).
/ Abbau eine Rolle). Transformationskinetik beschäftigt sich mit der Umsetzung des biologischen
Effekts. Dieser auch als Transduktion bezeichnete Vorgang umfasst z.B.
Veränderungen von Ionenpermeabilitäten und second-messenger- Mechanismen
(Enzymaktivierungen etc). 
 Abbildung: Die Rezeptorausstattung der Zelle bestimmt darüber, auf welche Hormone sie anspricht
Abbildung: Die Rezeptorausstattung der Zelle bestimmt darüber, auf welche Hormone sie anspricht Beispiel 1: Der aktivierte Rezeptor verändert die Ionen-Durchlässigkeit von
Permeasen oder aktiviert Membran-G-Proteine. Dies bewirkt die
Bildung eines zweiten Botenstoffs, entweder zyklisches
Adenosin-Monophosphat (cAMP) oder Diacylglycerin (DAG) plus
Inositoltriphosphat (IP3).
Beispiel 1: Der aktivierte Rezeptor verändert die Ionen-Durchlässigkeit von
Permeasen oder aktiviert Membran-G-Proteine. Dies bewirkt die
Bildung eines zweiten Botenstoffs, entweder zyklisches
Adenosin-Monophosphat (cAMP) oder Diacylglycerin (DAG) plus
Inositoltriphosphat (IP3).  cAMP wird durch das Enzym Adenylylcyclase
aus ATP gebildet, DAG und IP3 durch Phospholipase C aus Molekülen der
Zellmembran (
cAMP wird durch das Enzym Adenylylcyclase
aus ATP gebildet, DAG und IP3 durch Phospholipase C aus Molekülen der
Zellmembran ( s. dort).
s. dort).  Ca++-abhängige Kinase,
Ca++-abhängige Kinase,  Adenylylcyclase,
Adenylylcyclase,  Myosinleichtkettenkinase,
Myosinleichtkettenkinase,  die Phosphatase Calcineurin oder
die Phosphatase Calcineurin oder  endotheliale Stickstoffmonoxid-Synthase (eNOS).
endotheliale Stickstoffmonoxid-Synthase (eNOS). Beispiel 2:
Schilddrüsenhormone wirken über Rezeptoren im Zellkern, Steroidhormonrezeptoren liegen schon im Zytoplasma vor. Steroid- und
Schilddrüsenhormone koppeln sich von ihrem extrazellulären Transportermolekül
ab, durchdringen die
Zellmembran, gelangen in das Zytoplasma
(s. dort) und anschließend in den Zellkern. Hier binden sie an chromatinständige
Rezeptoren und initiieren so Transkription,
Proteinsynthese und Hormonwirkung.
Beispiel 2:
Schilddrüsenhormone wirken über Rezeptoren im Zellkern, Steroidhormonrezeptoren liegen schon im Zytoplasma vor. Steroid- und
Schilddrüsenhormone koppeln sich von ihrem extrazellulären Transportermolekül
ab, durchdringen die
Zellmembran, gelangen in das Zytoplasma
(s. dort) und anschließend in den Zellkern. Hier binden sie an chromatinständige
Rezeptoren und initiieren so Transkription,
Proteinsynthese und Hormonwirkung. Als Affinität
Als Affinität bezeichnet man die Stärke der Bindung zwischen einer singulären
Bindungsstelle (z.B. eines Rezeptors oder Antikörpers) und einem
Liganden (z.B. Hormon oder Antigen) - je höher
die Affinität, desto eher und intensiver erfolgt die Bindung. Die Affinität ist quantifizierbar über die
betreffende Dissoziationskonstante kd:
Das ist die molare Konzentration eines Liganden, die
erforderlich ist, um die Hälfte der vorhandenen Bindungspartner zu
besetzen. Je höher die für eine Bindung benötigte Konzentration eines
Bindungspartners, desto geringer ist die Bindungsaffinität.
bezeichnet man die Stärke der Bindung zwischen einer singulären
Bindungsstelle (z.B. eines Rezeptors oder Antikörpers) und einem
Liganden (z.B. Hormon oder Antigen) - je höher
die Affinität, desto eher und intensiver erfolgt die Bindung. Die Affinität ist quantifizierbar über die
betreffende Dissoziationskonstante kd:
Das ist die molare Konzentration eines Liganden, die
erforderlich ist, um die Hälfte der vorhandenen Bindungspartner zu
besetzen. Je höher die für eine Bindung benötigte Konzentration eines
Bindungspartners, desto geringer ist die Bindungsaffinität. Je niedriger der kd-Wert,
desto größer ist die Bindungsstärke (Affinität) - z.B. zwischen einem
Hormon und seinem Rezeptor - und umgekehrt. Beispiel: Hormon A hat für
ein bestimmtes zelluläres Rezeptorprotein einen kd-Wert von 0,6, Hormon B einen kd-Wert von 4,3. Hormon A hat die größere Bindungsstärke.
Je niedriger der kd-Wert,
desto größer ist die Bindungsstärke (Affinität) - z.B. zwischen einem
Hormon und seinem Rezeptor - und umgekehrt. Beispiel: Hormon A hat für
ein bestimmtes zelluläres Rezeptorprotein einen kd-Wert von 0,6, Hormon B einen kd-Wert von 4,3. Hormon A hat die größere Bindungsstärke. die Assoziationsgeschwindigkeitskonstante (ka) die der Assoziation,
die Assoziationsgeschwindigkeitskonstante (ka) die der Assoziation,  die Dissoziationsgeschwindigkeitskonstante (kd) die der Dissoziation.
die Dissoziationsgeschwindigkeitskonstante (kd) die der Dissoziation. 
 Abbildung: Isoflavon - Agonist oder Antagonist?
Abbildung: Isoflavon - Agonist oder Antagonist? Kompetition und Verdrängung. Oft sind Rezeptormoleküle mit mehreren Signalstoffen gleichzeitig konfrontiert, die an ihn (orthosterisch,
also an einen definierten Ort am Molekül) binden können. Da die
Anlagerung der einzelnen Hormon-, Transmitter-, Mediatormoleküle an den
Rezeptor reversibel ist und meist nur kurz dauert, findet ein ständiger
Wechsel der Bindungspartner statt. Bei gegebener Rezeptorzahl
entscheidet bei Anwesenheit berschiedener Liganden (z.B. eines Agonisten
und eines Antagonisten) einerseits die jeweilige Affinität,
andererseits die jeweilige Konzentration der Signalstoffe, wie hoch die
Wahrscheinlichkeit ist, dass an einem Rezeptormolekül gerade ein
bestimmter Signalstoff gebunden ist (occupancy: Rezeptorbesetzung).
Kompetition und Verdrängung. Oft sind Rezeptormoleküle mit mehreren Signalstoffen gleichzeitig konfrontiert, die an ihn (orthosterisch,
also an einen definierten Ort am Molekül) binden können. Da die
Anlagerung der einzelnen Hormon-, Transmitter-, Mediatormoleküle an den
Rezeptor reversibel ist und meist nur kurz dauert, findet ein ständiger
Wechsel der Bindungspartner statt. Bei gegebener Rezeptorzahl
entscheidet bei Anwesenheit berschiedener Liganden (z.B. eines Agonisten
und eines Antagonisten) einerseits die jeweilige Affinität,
andererseits die jeweilige Konzentration der Signalstoffe, wie hoch die
Wahrscheinlichkeit ist, dass an einem Rezeptormolekül gerade ein
bestimmter Signalstoff gebunden ist (occupancy: Rezeptorbesetzung).  Die
Wahrscheinlichkeit der (reversiblen) Bindung eines Antagonisten an
Rezeptormoleküle kann durch Erhöhung der Konzentration von Agonisten
verringert und damit die Blockade der Rezeptorwirkung durch den
Antagonisten gesenkt (die intrinsische Aktivität des Agonisten erhöht)
werden. Das Prinzip der Kompetition gilt allgemein, Kombinationen
physiologischer und/oder pharmakologischer Agonisten / Antagonisten
können so um Bindungsorte an zellulären Rezeptoren konkurrieren.
Die
Wahrscheinlichkeit der (reversiblen) Bindung eines Antagonisten an
Rezeptormoleküle kann durch Erhöhung der Konzentration von Agonisten
verringert und damit die Blockade der Rezeptorwirkung durch den
Antagonisten gesenkt (die intrinsische Aktivität des Agonisten erhöht)
werden. Das Prinzip der Kompetition gilt allgemein, Kombinationen
physiologischer und/oder pharmakologischer Agonisten / Antagonisten
können so um Bindungsorte an zellulären Rezeptoren konkurrieren. Der jeweils langsamste Prozess der betreffenden Wirkungskette ist für das Auftreten der Hormonwirkung
geschwindigkeitsbestimmend.
Der jeweils langsamste Prozess der betreffenden Wirkungskette ist für das Auftreten der Hormonwirkung
geschwindigkeitsbestimmend. Verteilung im Körper (Distribution),
Verteilung im Körper (Distribution),  Umwandlung und Verstoffwechselung (Metabolisierung) und
Umwandlung und Verstoffwechselung (Metabolisierung) und  Ausscheidung (Exkretion).
Ausscheidung (Exkretion).
 und diverse Kenngrößen
für Sekretion, Distribution, Kinetik, Metabolisierung und Ausscheidung
Berücksichtigung finden. Solche Modelle stehen insbesondere als
Instrument der Pharmakokinetik zur Verfügung.
und diverse Kenngrößen
für Sekretion, Distribution, Kinetik, Metabolisierung und Ausscheidung
Berücksichtigung finden. Solche Modelle stehen insbesondere als
Instrument der Pharmakokinetik zur Verfügung.

 Hormone werden
kontrolliert gebildet, gespeichert, freigesetzt und abgebaut /
ausgeschieden. Dabei ist ihre Sekretion an die aktuellen Anforderungen
geknüpft (Steuerung, Rückkopplung). Die Sollwerte hängen von Alter,
Geschlecht, Umstands- (Umgebungseinflüsse) und
zeitabhängigen Faktoren (zirkadian, jahreszeitlich) ab. Die
meisten Hormone sind Proteine / Peptide; sie werden synthetisiert
(Translation), modifiziert, gespeichert (Vesikel) und freigesetzt (Exozytose) -
letzteres Ca++-getriggert.
Andere Hormone werden aus Vorgängermolekülen enzymatisch hergestellt, z.B. biogene Amine, die
ebenfalls in Vesikeln gespeichert werden; Schilddrüsenhormone
extrazellulär, im Kolloid der Schilddrüsenfollikel. Kleine Hormonmoleküle (inklusive Peptidhormone)
gelangen in messbarer Konzentration in den Harn (z.B.
Schwangerschaftstest für hCG)
Hormone werden
kontrolliert gebildet, gespeichert, freigesetzt und abgebaut /
ausgeschieden. Dabei ist ihre Sekretion an die aktuellen Anforderungen
geknüpft (Steuerung, Rückkopplung). Die Sollwerte hängen von Alter,
Geschlecht, Umstands- (Umgebungseinflüsse) und
zeitabhängigen Faktoren (zirkadian, jahreszeitlich) ab. Die
meisten Hormone sind Proteine / Peptide; sie werden synthetisiert
(Translation), modifiziert, gespeichert (Vesikel) und freigesetzt (Exozytose) -
letzteres Ca++-getriggert.
Andere Hormone werden aus Vorgängermolekülen enzymatisch hergestellt, z.B. biogene Amine, die
ebenfalls in Vesikeln gespeichert werden; Schilddrüsenhormone
extrazellulär, im Kolloid der Schilddrüsenfollikel. Kleine Hormonmoleküle (inklusive Peptidhormone)
gelangen in messbarer Konzentration in den Harn (z.B.
Schwangerschaftstest für hCG) Hormone müssen an
Rezeptoren binden, um wirken zu können. Hormonrezeptoren sind für eine Hormonwirkung
unerlässlich. Agonisten binden ebenfalls an den Rezeptor und wirken
hormonähnlich, Antagonisten behindern die
Hormonwirkung. Hormone wirken
an Rezeptoren der Zellmembran, oder direkt im Zellinneren, dann meist
durch Eingriff in die Verwertung der Erbinformation. Hydrophile Hormone binden an membranständige Rezeptoren und
bewirken z.B.
Phosphorylierung von Enzymen. Histone und andere
Chromatinproteine im Zellkern können durch Acetylierung,
Phosphorylierung u.a. so beeinflusst werden, dass sich die Ablesbarkeit von DNA-Strecken verändert
Hormone müssen an
Rezeptoren binden, um wirken zu können. Hormonrezeptoren sind für eine Hormonwirkung
unerlässlich. Agonisten binden ebenfalls an den Rezeptor und wirken
hormonähnlich, Antagonisten behindern die
Hormonwirkung. Hormone wirken
an Rezeptoren der Zellmembran, oder direkt im Zellinneren, dann meist
durch Eingriff in die Verwertung der Erbinformation. Hydrophile Hormone binden an membranständige Rezeptoren und
bewirken z.B.
Phosphorylierung von Enzymen. Histone und andere
Chromatinproteine im Zellkern können durch Acetylierung,
Phosphorylierung u.a. so beeinflusst werden, dass sich die Ablesbarkeit von DNA-Strecken verändert  Ca++ kann Hormonwirkungen vermitteln - es wird auf Reizung hin aus dem endoplasmatischen Retikulum freigesetzt oder dringt über die Zellmembran aus dem Extrazellulärraum ein (Calciumkanäle).
Es aktiviert z.B. Kinasen, Adenylylcyclase, Myosinleichtkettenkinase,
Phosphatasen, endotheliale Stickstoffmonoxid-Synthase (eNOS). Dieser
Mechanismus wird von der Großzahl der Hormone, insbesondere von Peptid-
und Proteohormonen, benützt
Ca++ kann Hormonwirkungen vermitteln - es wird auf Reizung hin aus dem endoplasmatischen Retikulum freigesetzt oder dringt über die Zellmembran aus dem Extrazellulärraum ein (Calciumkanäle).
Es aktiviert z.B. Kinasen, Adenylylcyclase, Myosinleichtkettenkinase,
Phosphatasen, endotheliale Stickstoffmonoxid-Synthase (eNOS). Dieser
Mechanismus wird von der Großzahl der Hormone, insbesondere von Peptid-
und Proteohormonen, benützt Steroid- und
Schilddrüsenhormone dissoziieren am Zielort vom Transportermolekül,
durchdringen die Zellmembran, binden im Zytoplasma an Trägerproteine
und beeinflussen die Transkription von Zielgenen. Hormonresponsible
Elemente sind DNA-Sequenzen, an die der Hormonkomplex bindet und die
Expression bestimmter Schlüssenenzyme beeinflusst. So wird die Menge
der jeweiligen Enzyme erhöht (Induktion) oder erniedrigt (Repression);
solche Hormonwirkungen erfolgen verzögert. da die Neusynthese von Proteinen einige Zeit benötigt
Steroid- und
Schilddrüsenhormone dissoziieren am Zielort vom Transportermolekül,
durchdringen die Zellmembran, binden im Zytoplasma an Trägerproteine
und beeinflussen die Transkription von Zielgenen. Hormonresponsible
Elemente sind DNA-Sequenzen, an die der Hormonkomplex bindet und die
Expression bestimmter Schlüssenenzyme beeinflusst. So wird die Menge
der jeweiligen Enzyme erhöht (Induktion) oder erniedrigt (Repression);
solche Hormonwirkungen erfolgen verzögert. da die Neusynthese von Proteinen einige Zeit benötigt Die Gleichgewichtskonstante
eines Hormons bestimmt den Punkt, an dem ein bestimmtes Verhältnis der
Reaktionspartner (z.B. Hormon - Rezeptor, Antikörper - Antigen) keine Netto-Reaktion mehr ergibt
(Bindungsrate = Lösungsrate). Die Affinität gibt
die Beziehung Hormonkonzentration / Rezeptorbindungswahrscheinlichkeit
an; der reziproke Wert zur Assoziationskonstanten ist die Dissoziationskonstante (diese wird häufig zur Quantifizierung der Affinität angegeben). Transduktion (Transformation) betrifft den biologischen Effekt nach der Rezeptorbindung (Transformationskinetik) - das kann rasch (z.B. Hormonbindung → Membranpotentialänderung) oder langsam erfolgen (z.B. Genaktivierung → Proteinsynthese). Der jeweils langsamste Prozess der Wirkungskette ist für das Auftreten der Hormonwirkung geschwindigkeitsbestimmend
Die Gleichgewichtskonstante
eines Hormons bestimmt den Punkt, an dem ein bestimmtes Verhältnis der
Reaktionspartner (z.B. Hormon - Rezeptor, Antikörper - Antigen) keine Netto-Reaktion mehr ergibt
(Bindungsrate = Lösungsrate). Die Affinität gibt
die Beziehung Hormonkonzentration / Rezeptorbindungswahrscheinlichkeit
an; der reziproke Wert zur Assoziationskonstanten ist die Dissoziationskonstante (diese wird häufig zur Quantifizierung der Affinität angegeben). Transduktion (Transformation) betrifft den biologischen Effekt nach der Rezeptorbindung (Transformationskinetik) - das kann rasch (z.B. Hormonbindung → Membranpotentialänderung) oder langsam erfolgen (z.B. Genaktivierung → Proteinsynthese). Der jeweils langsamste Prozess der Wirkungskette ist für das Auftreten der Hormonwirkung geschwindigkeitsbestimmend