

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Wie werden
Hormonaktivitäten bestimmt?
Wie werden
Hormonaktivitäten bestimmt?
 Aschheim-Zondek-Test: Selmar Aschheim, Bernhard Zondek
Aschheim-Zondek-Test: Selmar Aschheim, Bernhard Zondek| Die Konzentration eines Hormons im Blut spiegelt nicht unbedingt seine biologische Wirkung wider: Ist z.B. der
Rezeptormechanismus an den Zielzellen defekt, bleibt die Wirkung auch bei hohen
Blutwerten des Hormons aus. Bioassays werden für Forschungs-, Entwicklungs- und Überprüfungszwecke verwendet - sie erlauben einen direkten biologischen Wirkungsnachweis (Quantifizierung eines definierten Hormoneffekts). Es gibt in-vitro-Modelle auf unterschiedlichen Komplexitätsstufen: Einzelzellen (Zellkulturen), Gewebe (z.B. Darmstreifen), Organe (z.B. Herzpräparate); oder man prüft - in vivo - an ganzen Organismen (Tiermodelle). Im klinischen Labor werden Konzentrationswerte von Hormonen im biologischen Substrat (meist Körperflüssigkeiten) ermittelt - mit physikalischen, biochemischen oder immuntechnischen Methoden. Analysen beruhen auf chromatographischen Verfahren (HPLC: high performance liquid chromatography); Massenspektrometrie (Steroide, Vitamin D, Medikamente, Proteine etc.); oder auf immunchemischen Techniken (für Hormone mit antigenen Eigenschaften, die mittels Antikörpern selektiv dargestellt werden können). Die Reaktion kann eine Agglutination, Immunpräzipitation, oder Markierung des Antikörpers sein - z.B. mit enzymatischer Aktivität (z.B. enzyme-linked immunosorbent assay, ELISA) oder mit radioaktiven Stoffen. |
 ermöglichen die
Abschätzung der Konzentration oder Wirksamkeit einer Substanz (eines
Hormons, Medikaments,..) durch die Quantifizierung der biologischen
Reaktion, welche diese Substanz auslöst.
ermöglichen die
Abschätzung der Konzentration oder Wirksamkeit einer Substanz (eines
Hormons, Medikaments,..) durch die Quantifizierung der biologischen
Reaktion, welche diese Substanz auslöst. 
 In-vitro-Modellen (z.B. Präparate, die mit einer
den Wirkstoff enthaltenden Flüssigkeit über- oder durchströmt werden)
über
In-vitro-Modellen (z.B. Präparate, die mit einer
den Wirkstoff enthaltenden Flüssigkeit über- oder durchströmt werden)
über 
 Tiermodelle (Untersuchung in vivo
Tiermodelle (Untersuchung in vivo  ) bis hin zu
) bis hin zu 
 klinischen Prüfungen.
klinischen Prüfungen. 
 Bioassays an Zellen (in vitro
Bioassays an Zellen (in vitro  : Zellkulturen), Geweben bzw. Organen (Darmstreifen, Herzpräparate
etc.) werden für Forschungs-, Entwicklungs- und Überprüfungszwecke
durchgeführt.
: Zellkulturen), Geweben bzw. Organen (Darmstreifen, Herzpräparate
etc.) werden für Forschungs-, Entwicklungs- und Überprüfungszwecke
durchgeführt.
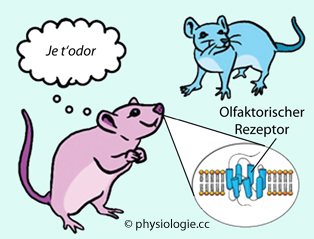
 Abbildung: Bioassay
Abbildung: Bioassay
 Abbildung), wobei der Vorteil
besteht, dass Reize von sehr geringer Intensität (z.B. Konzentration
eines Geruchsstoffs) wirksam werden und die komplexe Reaktion mit hoher
biologischer Relevanz einhergeht.
Abbildung), wobei der Vorteil
besteht, dass Reize von sehr geringer Intensität (z.B. Konzentration
eines Geruchsstoffs) wirksam werden und die komplexe Reaktion mit hoher
biologischer Relevanz einhergeht. Früher benutzte
man dazu genormte Tiermodelle, beispielsweise:
Früher benutzte
man dazu genormte Tiermodelle, beispielsweise: Der Galli-Mainini-Test
Der Galli-Mainini-Test
 (frog test) diente zum hCG-Nachweis über die
spermatogenetische Wirkung einer in den dorsalen Lymphsack injizierten Harnprobe bei jungen Krötenmännchen ("Krötentest")
(frog test) diente zum hCG-Nachweis über die
spermatogenetische Wirkung einer in den dorsalen Lymphsack injizierten Harnprobe bei jungen Krötenmännchen ("Krötentest") Beim Aschheim-Zondek-Test
Beim Aschheim-Zondek-Test  wurde
unreifen weiblichen Mäusen eine Harnprobe der fraglich schwangeren Frau
unter die Haut gespritzt und untersucht, ob die Tiere - die obduziert werden mussten - mit
einer Ovulation reagierten ("Mäusetest")
wurde
unreifen weiblichen Mäusen eine Harnprobe der fraglich schwangeren Frau
unter die Haut gespritzt und untersucht, ob die Tiere - die obduziert werden mussten - mit
einer Ovulation reagierten ("Mäusetest") Der Friedman-Test
Der Friedman-Test  (rabbit test) prüfte
die Reaktion der Eierstöcke eines Kaninchens auf eine Harninjektion -
auch diese Tiere wurden zum Zweck des Bioassays geopfert.
(rabbit test) prüfte
die Reaktion der Eierstöcke eines Kaninchens auf eine Harninjektion -
auch diese Tiere wurden zum Zweck des Bioassays geopfert. Massenspektrometrie
trennt Moleküle in einem Gemisch je nach ihrer molekularen Masse auf.
Ein Massenspektrometer besteht aus drei Komponenten:
Massenspektrometrie
trennt Moleküle in einem Gemisch je nach ihrer molekularen Masse auf.
Ein Massenspektrometer besteht aus drei Komponenten: Einem Ionisierer, der die Bestandteile in der Probe in Ionen verwandelt und diese als Gasphase zwecks Massenanalyse beschleunigt;
Einem Ionisierer, der die Bestandteile in der Probe in Ionen verwandelt und diese als Gasphase zwecks Massenanalyse beschleunigt; einem Analysator, der die Partikel nach ihrem Masse-zu-Ladungs-Verhältnis trennt;
einem Analysator, der die Partikel nach ihrem Masse-zu-Ladungs-Verhältnis trennt; einem Ionendetektor, auf den die Partikel treffen. Der Impact der einzelnen Ionen wird aufzgezeichnet, bei bekannter Ladung resultiert aus der Laufzeit die Masse.
einem Ionendetektor, auf den die Partikel treffen. Der Impact der einzelnen Ionen wird aufzgezeichnet, bei bekannter Ladung resultiert aus der Laufzeit die Masse.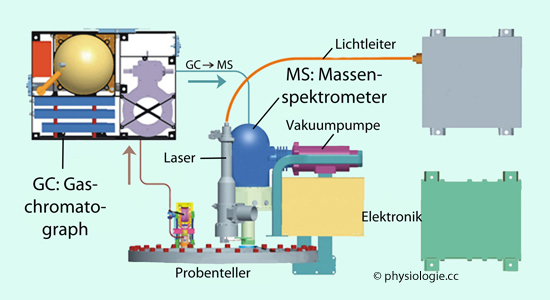
 Abbildung: GC-MS-Messplatz
Abbildung: GC-MS-Messplatz
 Abbildung). Massenspektrometrisch bestimmt werden z.B. Steroide,
Vitamin D, Medikamente ("individualisierte Medizin", drug monitoring),
aber auch Proteine oder DNA-Amplifikate. Die chromatographische Auftrennung kann in einer Flüssigkeitsphase (folgende
Abbildung). Massenspektrometrisch bestimmt werden z.B. Steroide,
Vitamin D, Medikamente ("individualisierte Medizin", drug monitoring),
aber auch Proteine oder DNA-Amplifikate. Die chromatographische Auftrennung kann in einer Flüssigkeitsphase (folgende  Abbildung: liquid chromatography, LC) oder in einem Trägergas erfolgen (Gaschromatographie).
Abbildung: liquid chromatography, LC) oder in einem Trägergas erfolgen (Gaschromatographie). Verfahren
beruhen, nützen die unterschiedliche Wanderungsgeschwindigkeit
verschiedener Moleküle in einem Gas oder einer (Körper-) Flüssigkeit
("mobile Phase") in einem Trägermedium ("stationäre Phase").
Die
nacheinander an einem Sensor vorbeikommenden Molekülfraktionen werden
von diesem (optisch) detektiert und das entsprechende Signal
quantifiziert.
Verfahren
beruhen, nützen die unterschiedliche Wanderungsgeschwindigkeit
verschiedener Moleküle in einem Gas oder einer (Körper-) Flüssigkeit
("mobile Phase") in einem Trägermedium ("stationäre Phase").
Die
nacheinander an einem Sensor vorbeikommenden Molekülfraktionen werden
von diesem (optisch) detektiert und das entsprechende Signal
quantifiziert. 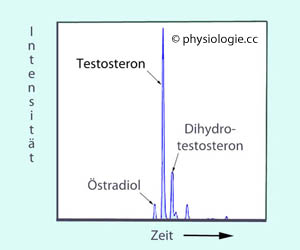
 Abbildung: Beispiel einer Hormonanalyse mittels LC-MS
Abbildung: Beispiel einer Hormonanalyse mittels LC-MS

 Abbildung: Prinzip des Radioimmunoassay (RIA)
Abbildung: Prinzip des Radioimmunoassay (RIA)
 Immunchemische
Techniken ermöglichen sehr spezifische Detektion von Molekülen,
die gute antigene Eigenschaften haben und daher mittels Antikörpern
selektiv dargestellt werden können - z.B. Agglutination,
Immunpräzipitation, oder mit Markierung (z.B. mit enzymatischer
Aktivität oder radioaktiven Stoffen) des Antikörpers (Immunoassay:
Nachweis eines gelösten Analyten durch Bindung an einen Antikörper).
Ein Beispiel ist der Enzyme-linked immunosorbent assay (ELISA), der auf einer enzymatischen Farbreaktion beruht.
Immunchemische
Techniken ermöglichen sehr spezifische Detektion von Molekülen,
die gute antigene Eigenschaften haben und daher mittels Antikörpern
selektiv dargestellt werden können - z.B. Agglutination,
Immunpräzipitation, oder mit Markierung (z.B. mit enzymatischer
Aktivität oder radioaktiven Stoffen) des Antikörpers (Immunoassay:
Nachweis eines gelösten Analyten durch Bindung an einen Antikörper).
Ein Beispiel ist der Enzyme-linked immunosorbent assay (ELISA), der auf einer enzymatischen Farbreaktion beruht. Abbildung). Aus der Beziehung Radioaktivität vs. Konzentration
(des Hormons) ergibt sich eine Eichkurve; eine gegebene Aktivität
entspricht dann der Konzentration (unmarkierten) Hormons in der
betreffenden Probe.
Abbildung). Aus der Beziehung Radioaktivität vs. Konzentration
(des Hormons) ergibt sich eine Eichkurve; eine gegebene Aktivität
entspricht dann der Konzentration (unmarkierten) Hormons in der
betreffenden Probe.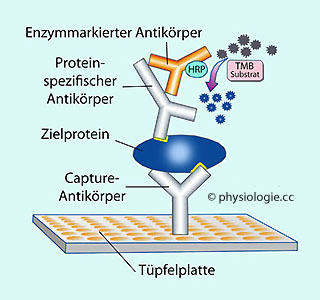
 Abbildung: Immunoassay
Abbildung: Immunoassay TMB, Tetramethylbenzidin, ein (von mehreren verschiedenen) Indikator(en), der durch Aktivität der Meerrettichperoxidase Farbe annimmt und die Reaktion dadurch sichtbar macht
TMB, Tetramethylbenzidin, ein (von mehreren verschiedenen) Indikator(en), der durch Aktivität der Meerrettichperoxidase Farbe annimmt und die Reaktion dadurch sichtbar macht

 Rasche
Zeitverläufe (z.B. Vasopressin, Oxytozin, Adrenalin - Hormone mit
geringer biologischer Halbwertszeit) lassen sich durch frequente
Analyse von
Blutproben erfassen. Der Kreislauf ist der primäre Verteiler
von Stoffen im Körper; Blut braucht - bei körperlicher Ruhe -im
Durchschnitt etwa eine Minute für einen Rundlauf (z.B. mit dem linken
Ventrikel als "checkpoint"), manchmal ist es schneller zurück (bei
Passage der Nieren ca. 20 Sekunden), manchmal braucht es länger (bei
gering durchbluteten bzw. peripheren Organen). Bei Muskelarbeit
verringert sich die mittlere Kreislaufzeit stark. Will man z.B. ein 24-Stunden-Profil
des Zeitverlaufs einer Substanz ermitteln, deren extrazelluläre
Konzentration sich rasch ändert, tut man dies an Körperstellen, die
einer entsprechenden Messung zugänglich sind (Haut, evt. Schleimhäute),
oder man erstellt eine Messreihe mit Blutproben (was einen erheblichen
Aufwand bedeutet).
Rasche
Zeitverläufe (z.B. Vasopressin, Oxytozin, Adrenalin - Hormone mit
geringer biologischer Halbwertszeit) lassen sich durch frequente
Analyse von
Blutproben erfassen. Der Kreislauf ist der primäre Verteiler
von Stoffen im Körper; Blut braucht - bei körperlicher Ruhe -im
Durchschnitt etwa eine Minute für einen Rundlauf (z.B. mit dem linken
Ventrikel als "checkpoint"), manchmal ist es schneller zurück (bei
Passage der Nieren ca. 20 Sekunden), manchmal braucht es länger (bei
gering durchbluteten bzw. peripheren Organen). Bei Muskelarbeit
verringert sich die mittlere Kreislaufzeit stark. Will man z.B. ein 24-Stunden-Profil
des Zeitverlaufs einer Substanz ermitteln, deren extrazelluläre
Konzentration sich rasch ändert, tut man dies an Körperstellen, die
einer entsprechenden Messung zugänglich sind (Haut, evt. Schleimhäute),
oder man erstellt eine Messreihe mit Blutproben (was einen erheblichen
Aufwand bedeutet).  Hormonnachweise
erfolgen im klinischen Labor mittels physiko-, bio-,
immunchemischer Methoden. Sie testen auf die Menge (Konzentration) des
Hormons im biologischen Substrat (z.B. Blutplasma, Harn). Immunchemische
Techniken detektieren Moleküle mit ausgeprägten antigenen Eigenschaften mittels Antikörpern: Agglutination,
Immunpräzipitation, Markierung mit enzymatischer
Aktivität oder radioaktiven Stoffen (Immunoassay). Kreuzreaktionen können das Ergebnis verfälschen Hormonnachweise
erfolgen im klinischen Labor mittels physiko-, bio-,
immunchemischer Methoden. Sie testen auf die Menge (Konzentration) des
Hormons im biologischen Substrat (z.B. Blutplasma, Harn). Immunchemische
Techniken detektieren Moleküle mit ausgeprägten antigenen Eigenschaften mittels Antikörpern: Agglutination,
Immunpräzipitation, Markierung mit enzymatischer
Aktivität oder radioaktiven Stoffen (Immunoassay). Kreuzreaktionen können das Ergebnis verfälschen Chromatographische / massenspektrometrische Verfahren (GC-MS) nützen die unterschiedliche Wanderungsgeschwindigkeit der
Moleküle in einem Trägermedium, die nacheinander am Sensor
vorbeikommenden Molekülfraktionen werden detektiert / quantifiziert. Massenspektrometrische Nachweise sind im Vergleich zu immunchemischen Methoden absolut verlässlich; bei Antikörpern können Kreuzreaktionen auftreten Chromatographische / massenspektrometrische Verfahren (GC-MS) nützen die unterschiedliche Wanderungsgeschwindigkeit der
Moleküle in einem Trägermedium, die nacheinander am Sensor
vorbeikommenden Molekülfraktionen werden detektiert / quantifiziert. Massenspektrometrische Nachweise sind im Vergleich zu immunchemischen Methoden absolut verlässlich; bei Antikörpern können Kreuzreaktionen auftreten Physiko-, bio- oder
immunchemische Messungen bestimmen lediglich Konzentrationswerte in der untersuchten Probe; ob oder wie stark ein Hormon
im Körper tatsächlich wirksam wird, zeigen sie nicht an. Entscheidend ist das volle
Funktionieren der biologischen Reaktionskette (Rezeptor, Sekundärreaktionen, second messenger, Enzyme, Genexpression) Physiko-, bio- oder
immunchemische Messungen bestimmen lediglich Konzentrationswerte in der untersuchten Probe; ob oder wie stark ein Hormon
im Körper tatsächlich wirksam wird, zeigen sie nicht an. Entscheidend ist das volle
Funktionieren der biologischen Reaktionskette (Rezeptor, Sekundärreaktionen, second messenger, Enzyme, Genexpression)  Bioassays
messen die biologische Wirksamkeit von Hormonen über die
Quantifizierung physiologischer Effekte. Zu Bioassays
gehören in-vitro-Modelle (z.B. Zellkulturen, Darmstreifen, Herzpräparate),
Tier- und Humanmodelle (in vivo). Bioassays werden für Forschungs-,
Entwicklungs- und Überprüfungszwecke durchgeführt. Die
Wirkung wird im Vergleich zu einem Standard (Referenz) angegeben (relative Quantifikation)
Bioassays
messen die biologische Wirksamkeit von Hormonen über die
Quantifizierung physiologischer Effekte. Zu Bioassays
gehören in-vitro-Modelle (z.B. Zellkulturen, Darmstreifen, Herzpräparate),
Tier- und Humanmodelle (in vivo). Bioassays werden für Forschungs-,
Entwicklungs- und Überprüfungszwecke durchgeführt. Die
Wirkung wird im Vergleich zu einem Standard (Referenz) angegeben (relative Quantifikation) Die
Darstellung rascher Zeitverläufe (z.B. 24-Stunden-Profil eines Hormons
im Kreislauf) erfordert die Analyse wiederholt abgenommener Blutproben.
Die Konzentration stressabhängiger Hormone (z.B. Adrenalin, Kortisol) kann wegen Invasivität / psychischer Belastung deutlich ansteigen. Hormonanalysen können auch an Speichel-, Harn-, Haar- oder Stuhlproben erfolgen, mit unterschiedlichen Verzögerungen / Mittelungen des hormonellen Zeitprofils. Der Kortisolgehalt in Haarwurzelproben ist repräsentativ für einen Zeitraum von Wochen bis Monaten vor der Probenentnahme Die
Darstellung rascher Zeitverläufe (z.B. 24-Stunden-Profil eines Hormons
im Kreislauf) erfordert die Analyse wiederholt abgenommener Blutproben.
Die Konzentration stressabhängiger Hormone (z.B. Adrenalin, Kortisol) kann wegen Invasivität / psychischer Belastung deutlich ansteigen. Hormonanalysen können auch an Speichel-, Harn-, Haar- oder Stuhlproben erfolgen, mit unterschiedlichen Verzögerungen / Mittelungen des hormonellen Zeitprofils. Der Kortisolgehalt in Haarwurzelproben ist repräsentativ für einen Zeitraum von Wochen bis Monaten vor der Probenentnahme |
