

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

 Abszess: abs-cedere = sich zurückziehen, weichen (abscessus = Eitergeschwulst)
Abszess: abs-cedere = sich zurückziehen, weichen (abscessus = Eitergeschwulst)
Alopezie: ἀλώπηξ = Fuchs(fell)
Osteomyelitis: ὀστέον = Knochen, μυελός = Mark
Pyodermie: πυον = Eiter, δέρμα = Haut
Soor: sohren (altdeutsch) = wundmachen (engl. sore)
Immunologische Diagnostik orientiert sich an klinischen Symptomen
(Entzündungszeichen, geschwollene Lymphknoten,..), Labordiagnostik (Differenzialblutbild, Immunglobuline, Komplementfaktoren,
HLA-Typisierung) und in-vivo-Assays (Hauttests).
Aufgrund der enormen
Komplexität des Immunsystems können klinische Indizien zum Teil
widersprüchlich erscheinen; mangelnde oder
überschießende Immunaktivität (Anergie, Hyperergie) äußern sich nicht
immer in Form eindeutiger Befunde.
Immunoassays können z.B. als Radioimmunoassay (RIA) oder Enzyme-Linked Immunosorbent Assay (ELISA) zum Einsatz gelangen. Bei der Durchflusszytometrie
werden einzelne Zellen an einem Detektor vorbeigeführt und Färbung bzw.
Markierung erfasst (Streulicht, Fluoreszenz), auch
kann auf diesem Wege eine CD-Klassifizierung (Cluster of differentiation) erfolgen.
|
So gibt es eine
starke Wechselbeziehung zwischen Stress und
Abwehrkraft. Man
orientiert sich an der Anamnese genauso wie an verschiedenen Indizien,
Symptomen und Laboruntersuchungen.
Klinisch liegt der Verdacht auf ein immunpathologisches Geschehen vor, wenn
 Anamnese und Befund
Anamnese und Befund auffällig sind (z.B. Hautbefunde wie Pyodermie

, schwere Abszesse

, Alopezie

)

Infektionen mit auffälliger
Häufigkeit auftreten

Erreger im Spiel sind, gegen die eigentlich ein
Impfschutz vorliegen sollte

Lymphatisches
Gewebe reduziert ist (mangelnde Ausbildung / Reaktion von Lymphknoten, Fehlen von Tonsillen, Thymus,..)
 Ungewöhnliche
Ungewöhnliche (insbesondere opportunistische) Keime im Vordergrund stehen (die normalerweise nicht exazerbieren)

Infektionen auffällig
verlaufen (z.B. in den Nebenhöhlen, Mundsoor - Kandidose -, Osteomyelitiden

usw.)
 Autoimmungeschehen
Autoimmungeschehen auftreten
Eine fehlgelaufene Immunantwort muss noch keinen Immundefekt bedeuten.
Liegt ein solcher tatsächlich vor, muss festgestellt werden, welche
Komponente des Immunsystems betroffen ist. In diesem Fall ist die
Anwendung spezieller Labordiagnostik angezeigt:
 Allgemein:
Allgemein:
 Weiterführend
Weiterführend:
 Phagozyten
Phagozyten.
Die Fähigkeit von Phagozyten, antigenbeladene Partikel (Latexkügelchen,
Zellen, Bakterien) aufzunehmen, wird unter dem Mikroskop untersucht und
spiegelt ihre Funktionstüchtigkeit wider.

Proliferation mononukleärer Zellen:
Lymphozyten,
Monozyten oder
dendritische Zellen
werden isoliert und für 2-3 Tage in eine Gewebekultur verbracht. Dann
wird ein Antigen (welchem die untersuchte Person möglicherweise
ausgesetzt war) und seine Aufnahme durch die mononukleären Zellen
bestimmt.
 T-Zell-System
T-Zell-System (In-vitro-Funktion, Immunphänotypisierung; T-Zell-Defekt?)
 B-Zell-System
B-Zell-System (in vivo, in vitro; humoraler Immundefekt?)
 Zytokine
Zytokine (z.B.
IL-6 <11,3 ng/l,
IL-8 <62 ng/l,
TNF-α <8 ng/l)
 T-Lymphozyten
T-Lymphozyten
700-2200 /µl Blut
(CD4-Helferzellen 400-1500,
CD8-Suppressorzellen 290-1100)
 B-Lymphozyten
B-Lymphozyten
80-450 /µl Blut
 NK-Zellen
NK-Zellen
100-640 /µl Blut
Viele klinische Laboruntersuchungen beruhen auf der spezifischen Erkennung von in Lösung
befindlichen Epitopen durch Antikörper (Agglutinationstests,
Immundiffusionstest, Immunelektrophorese, Western blotting,
Radioimmunoassay, ELISA, Fluoreszenz-Immunosorbent Assay). Epitope auf oder in Zellen
können ebenfalls nachgewiesen werden (Immunfluoreszenz,
Durchflusszytometrie). Schließlich lässt sich die Funktionstüchtigkeit
isolierter Immunzellen testen (Phagozytose, Proliferation, Zytolyse).
Üblicherweise
erfolgt die Quantifizierung eines in Lösung befindlichen Antigens über eine Präzipitationskurve,
über die der Antikörpertiter gegen das in Frage stehende Antigen
bestimmt werden kann ( Abbildung):
Abbildung):

 Abbildung: Bestimmung des Antikörpertiters
Abbildung: Bestimmung des Antikörpertiters
Modifiziert nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Vorbereitung:
Erstellung einer Verdünnungsreihe. Blutserum (mit fraglichem
Antikörper) der zu untersuchenden Person wird schrittweise verdünnt
(1/2, 1/4, 1/8 etc). Dadurch nimmt die allfällige
Antikörperkonzentration auf 50%, 25%, 12,5% etc. der (eventuellen)
Konzentration des Antikörpers im Serum ab.
Antigen-Antikörper-Reaktion: Das interessierende Antigen (das multiple
Epitope enthält) wird in immer gleicher Menge zu den Proben der
Verdünnungsreihe zugegeben. Falls das Serum Antikörper enthält,
entstehen Komplexe unterschiedlicher Ausprägung (je nach
Antikörperkonzentration).
Reaktion mit gelösten Antigenen: Die Präzipitationskurve lässt drei Zonen erkennen: In der "Äquivalenzzone"
(Mitte) erfolgt die stärkste Quervernetzung zwischen Antigen und
Antikörper und infolge dessen intensive Präzipitation. Bei
Antikörperüberschuss (geringe Serumverdünnung, links) finden zahlreiche
Antikörpermoleküle kein Epitop zur Bindung, da bereits alle Epitope mit
anderen Antikörpermolekülen besetzt sind. Bei Antigenüberschuss
(rechts) ist es umgekehrt, in stark verdünnten Serumproben sind nur
wenige Antikörper für eine Bindung verfügbar. Die Verdünnung, die
gerade noch eine nachweisbare Präzipitation erzielt, wird als Antikörpertiter bezeichnet (z.B. 1:64).
Auch die Präzipitation
von partikulären Antigenträgern (Zellen, Bakterien, Partikeln) hängt
vom Verhältnis Antigen (konstant) / Antikörper (durch Verdünnung
variabel) ab.
Agglutination (Verklumpung) erfolgt bei mäßiger Serumverdünnung. In der
"Prozone" (links) ist die Antikörperkonzentration für eine
Agglutination zu hoch, bei hoher Serumverdünnung (rechts) zu niedrig,
um Agglutinate auszubilden

Soll die Anwesenheit von Antikörpern, die anderen Klassen
als IgM angehören (z.B. IgG), im Patientenserum nachgewiesen werden,
ergibt sich das Problem, dass diese meist keine brauchbare
Agglutination der Antigenträger bewirken. Das kann auch gelten, wenn
die Antikörperkonzentration im Serum sehr gering ist. In solchen Fällen
wird das Prínzip der indirekten ("passiven") Agglutinationsreaktion genutzt ( Abbildung).
Abbildung).
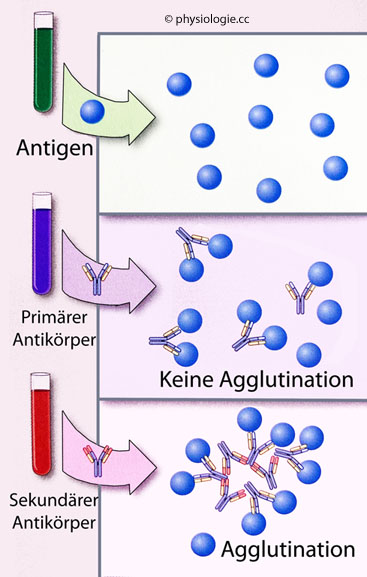
 Abbildung: Indirekte (passive) Agglutinationsreaktion
Abbildung: Indirekte (passive) Agglutinationsreaktion
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Die Methode dient zur Verstärkung der Reaktion bei niedrigen Antikörperspiegeln oder zum Nachweis von IgG in Patientenserum.
Antigenträger (Zellen, Bakterien, Latexpartikel - "Antigen") werden mit
einer Serumprobe der zu untersuchenden Person inkubiert (Mitte). Dieses
enthält eventuell Antikörper, die gegen das interessierende Antigen
gerichtet sind ("primärer" Antikörper). Der Antikörper bindet
zwar an "seine" Epitope, diese Reaktion ruft aber keine bzw. nur
schwache Agglutination der Antigenträger hervor.
In einem zweiten Schritt (unten) werden "sekundäre" Antikörper (second-step antibodies, z.B. von Kaninchen) zugefügt. Diese erkennen und binden die primären Antikörper und vernetzen (agglutinieren) über sie die Antigenträger. Diese Reaktion ist deutlich nachweisbar

Indirekte
Agglutinationsreaktionen können die Bindung spezifischer Antikörper
(meist IgG) an die Antigenträger (z.B. Bakterien) nachweisbar machen
oder auch Reaktionen mit primären Antikörpern verstärken, deren Effekt
für einen klaren Nachweis nicht ausreichend ist.
Epitope gelöster Antigene können u.a. mittels radialer Immundiffusion (Mancini-Test) nachgewiesen
und quantifiziert werden. Serum mit einer definierten Konzentration von
Antikörpern wird in ein flüssiges Agargel verbracht, wo es sich
gleichmäßig verteilt. Dann wird das Gel abgekühlt und auf einen Träger
(Glas oder Kunststoff) aufgebracht. In diesen flachen Gelblock wird ein
Loch gestanzt, in das das Antigen verbracht wird.
Das Antigen diffundiert von hier in das Gel und reagiert mit
dem (in ihm fixierten) Antikörper. Es resultiert ein
Präzipitationsring, der mit der Zeit radial nach außen wandert.
Schließlich bleibt der Ring stationär, und sein Durchmesser ist direkt
proportional der Antigenkonzentration in der Probe.
Dies ist ein Beispiel für eine Einfachdiffusionstechnik,
es diffundiert nur das Antigen oder der Antikörper, der jeweils andere
Reaktionspartner ist im Gel fixiert (er bleibt stationär). Der
Versuchsaufbau kann aber auch beide Komponenten (Antigen und
Antikörper) gleichzeitig wandern lassen (Doppeldiffusion). Das kann zusätzlich mit einer Elektrophorese kombiniert werden:

 Abbildung: Immunelektrophorese
Abbildung: Immunelektrophorese
Modifiziert nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Von
oben nach unten ist der Ablauf dargestellt. In einen Agargelblock
werden eine runde und eine längliche Vertiefung gestanzt. Dann wird ein
Antigengemisch in die runde Vertiefung eingebracht und
elektrophoretisch aufgetrennt. Antigene wandern entsprechend ihrer
Ladung, Molekülgröße und -form zur Anode (links) bzw. Kathode (rechts).
Nach Abschalten des Elektrophoresestroms beginnen sie, ringförmig in
das Gel zu diffundieren.
Nun wird das Antiserum mit Antikörpern (die ein oder mehrere Epitope
erkennen können) in die längliche Stanze eingebracht und diffundiert
etwa linear den Antigengruppen entgegen. An den Orten, wo sie
aufeinander treffen, entstehen Präzipitationsbögen

Bei der Immunelektrophorese (IEP)
handelt es sich um eine Erweiterung der Doppeldiffusionstechnik ( Abbildung). Ein Antigengemisch wird zuerst elektrophoretisch
in mehrere Komponenten aufgetrennt, und die entstandenen Fraktionen
diffundieren in der Folge gegen eine "Front" von Antikörpern.
Abbildung). Ein Antigengemisch wird zuerst elektrophoretisch
in mehrere Komponenten aufgetrennt, und die entstandenen Fraktionen
diffundieren in der Folge gegen eine "Front" von Antikörpern.
Die entstehenden Präzipitationsbögen signalisieren jeweils eigene
Antigene. Die Methode ist qualitativ (z.B. beantwortet sie die Frage,
ob eine bestimmte Immunglobulinklasse im fraglichen Serum vorhanden ist
oder nicht), lässt aber keine genaue Quantifizierung der
Antigenfraktionen zu.
Eine weitere Methode zum Nachweis spezifischer Proteine ist das Immunoblotting (Western blotting,  s. dort).
s. dort).
Quantitative Epitopnachweise: Immunoassays
Immunoassays (vgl. dort) zielen auf quantitative Antigenerkennung durch spezifische Antikörper ab.
Antigene und Antikörper sind Bindungspartner (Liganden), die - in
verschiedensten Testansätzen - mit Enzymen (Nachweis der Enzymwirkung),
radioaktiven (Nachweis der radioaktiven Strahlung), fluoreszierenden
(Nachweis der Lichtstrahlung) oder anderen Markern kombiniert
werden. Das Ausmaß der enzymatischen oder Strahlungsaktivität kann dann
als Hinweis auf die Konzentration des jeweiligen markierten Liganden im
betreffenden Testansatz herangezogen werden.
 Radioimmunassay (RIA): Quantitativer Nachweis von Infektionsantigenen im Blut. Direkte (direct RIA) oder indirekte (indirect RIA)
Antikörper (vgl. oben) können eingesetzt werden, wegen der
Strahlenbelastung des Laborpersonals sowie unvermeidlichen
Entsorgungsproblemen (radioaktiver Abfall) werden RIAs nur noch selten
verwendet.
Radioimmunassay (RIA): Quantitativer Nachweis von Infektionsantigenen im Blut. Direkte (direct RIA) oder indirekte (indirect RIA)
Antikörper (vgl. oben) können eingesetzt werden, wegen der
Strahlenbelastung des Laborpersonals sowie unvermeidlichen
Entsorgungsproblemen (radioaktiver Abfall) werden RIAs nur noch selten
verwendet.

Festphasen-Enzym-Immunosorbent-Assays (EIA) bieten Alternativen zum klassischen RIA:

 Enzyme Linked Immunosorbent Assay
(ELISA): Nachweis von Proteinen, z.B. Antikörpern, Viren. Dieser Test
hat weitgehend Radioimmunoassays (RIA) ersetzt - er ist sicher, der
Zeitaufwand für seine Durchführung gering, die Reagenzien sind relativ
stabil und die Sensitivität übertrifft teilseise die eines RIA. ELISAs
sind spezifisch und quantitativ.
Enzyme Linked Immunosorbent Assay
(ELISA): Nachweis von Proteinen, z.B. Antikörpern, Viren. Dieser Test
hat weitgehend Radioimmunoassays (RIA) ersetzt - er ist sicher, der
Zeitaufwand für seine Durchführung gering, die Reagenzien sind relativ
stabil und die Sensitivität übertrifft teilseise die eines RIA. ELISAs
sind spezifisch und quantitativ.
Zur Durchführung eines ELISA werden Antigene in gelöster Form auf
proteinabsorbierenden Polystyren-Platten (die 96 Vertiefungen
aufweisen) aufgebracht. Antigen bindet an den Kunststoff, der Überstand
wird abgewaschen, primäre Antikörper (oftmals im zu untersuchenden
Serum) zugesetzt, ungebundene Antikörper abgewaschen. Dann werden
enzymmarkierte Antikörper
zugesetzt, die an die (gebundenen) primären
Antikörper koppeln (der Überstand wiederum abgewaschen). Nun wird ein
durch das Enzym spaltbares Chromogen (eine farblose oder nur schwach
gefärbte Substanz, welche durch eine chemische Reaktion intensive Farbe
annimmt) zugesetzt. Nach Inkubation zeigt
der Farbwechsel den Grad der Anwesenheit sekundären Antikörpers - und
indirekt die Menge an Epitop (an welches der primäre Antikörper
gebunden hat) an.
 Ein Fluorescent immunosorbent Assay
(FIA) verwendet fluoreszierende Marker
(FITC:
Fluorescein-Isothiocyanat, PE: Phycoerythrin). Diese leuchten kurz nach
Anregung durch Licht auf (meist mit Photonen geringerer Energie als das
der Anregung; als Fluorophor bezeichnet man ein System, das Fluoreszenz erkennen läßt; Fluorochrome bzw. Fluoreszenzfarbstoffe sind für Färbungen verwendete fluoreszierende Substanzen).
Ein Fluorescent immunosorbent Assay
(FIA) verwendet fluoreszierende Marker
(FITC:
Fluorescein-Isothiocyanat, PE: Phycoerythrin). Diese leuchten kurz nach
Anregung durch Licht auf (meist mit Photonen geringerer Energie als das
der Anregung; als Fluorophor bezeichnet man ein System, das Fluoreszenz erkennen läßt; Fluorochrome bzw. Fluoreszenzfarbstoffe sind für Färbungen verwendete fluoreszierende Substanzen).
Einer der Liganden
(Antigen oder Antikörper) wird auf eine Polystyrenoberfläche fixiert
(immobilisiert), bevor der mit einem Fluorochrom markierte
Bindungspartner zugesetzt wird. Je stärker die Bindung, desto
intensiver die Fluoreszenz.
Epitoperkennung in oder auf Zellen
Mit
Enzym, Fluorochrom oder radioaktiver Substanz markierte Antikörper
werden auch zum Nachweis antigener Strukturen auf der Oberfläche (an
die Außenmembran gebunden) oder im Inneren von Zellen verwendet.
Besonders oft finden zwei der zahlreichen Methoden Verwendung:
Immunfluoreszenz und Durchflusszytometrie.
Immunfluoreszenz
Immunfluoreszenz (IF) nützt
fluoreszierende Marker (wie FITC), die kovalent an Antikörpermoleküle
gebunden sind. Der Marker kann sich direkt auf dem primären Antikörper
befinden, oder der unmakrierte spezifische Antikörper wird durch einen
zweiten (mit Fluorochrom markierten) detektiert (indirekte
Darstellung):
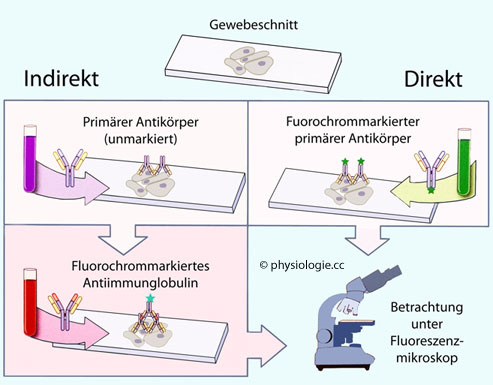

Abbildung: Immunfluoreszenz (IF)
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Ein auf einem Objektträger befindlicher Gewebeschnitt wird fluoreszenzmikroskopisch untersucht.
Links: Indirekte IF. Der Gewebeschnitt wird zuerst mit unmarkiertem
Antikörper behandelt, der das nachzuweisende Epitop erkennt und an
dieses bindet. Anschließend wird der Schnitt gewaschen (nicht gebundene
Antikörper entfernt) und ein sekundärer (markierter) Antikörper (der an
Antikörperepitope bindet) aufgebracht. Das Präparat wird inkubiert,
dann wiederum gewaschen. An das Gewebe gebundene Antikörper leuchten bei fluoreszenzmikroskopischer Betrachtung auf.
Rechts: Direkte IF. Können die primären Antikörper direkt mit dem
Fluorochrom markiert werden, entfällt die Notwendigkeit für einen
zweiten Indikator-Antikörper

Gewebeschnitte werden in Antikörperlösung gebadet (FITC-markierte
Antikörper bzw. primäre Antikörper, die anschließend mit sekundären
markiert werden), gewaschen und die Intensität der Antigendetektion
fluoreszenzmikroskopisch bestimmt.
Durchflusszytometrie
Als gut standardisierbare Untersuchungs- und Diagnosemethode wird die Durchflusszytometrie
(flow cytometry) u.a. in der Immunologie eingesetzt. Dabei werden einzelne Zellen in
einer Suspension (aufbereitete Blutprobe) an einer optischen oder
elektrischen Detektionsstelle vorbeigeführt; die Detektionsrate liegt
in der Größenordnung >103 Zellen pro Sekunde. Dabei treten
Effekte auf, die von der Morphologie oder Färbung / Markierung der
Zellen abhängen (Streulicht, Fluoreszenz) und von Detektoren erfasst
werden.
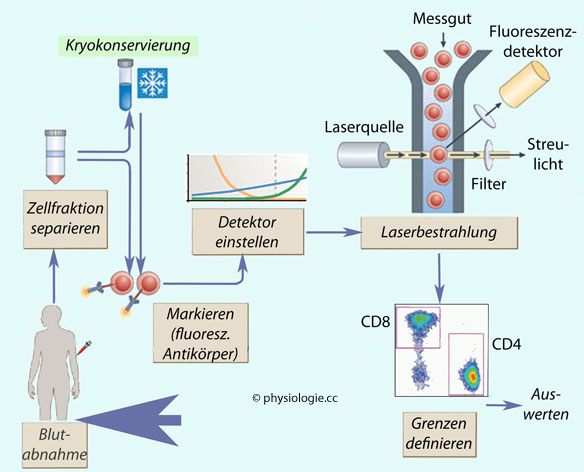
 Abbildung: Immunophenotyping
Abbildung: Immunophenotyping
Nach Maecker HT et al, Standardizing immunophenotyping for the
Human Immunology Project. Nat Rev Immunol 2012; 12: 191-200
Beispiel eines durchflusszytometrischen Versuchsaufbaus. Kryokonservierung
optional. Zellen werden mit Immunfluoreszenz markiert, der Detektor
(Photomultiplier) auf optimale Empfindlichkeit eingestellt.
Jeder
dieser Schritte kann zwischen verschiedenen Labors methodisch variieren, was die
Ergebnisse bzw. Normwertbereiche beeinflusst

Größe und Strukturmerkmale (Komplexität) jeder Zelle bestimmt die Menge des detektierten Lichts. So weisen Granulozyten eine rauhe Oberfläche und zahlreiche Vesikel auf und streuen deshalb mehr Licht als T-Zellen mit ihrer glatten Oberfläche und weniger komplexen Strukturierung.
Das entstehende Vorwärtsstreulicht (FSC = Forward Scatter) und Seitwärtsstreulicht (SSC = Side Scatter) haben unterschiedliche Bedeutung ( Abbildung):
Abbildung):
 FSC hängt vom Zellvolumen ab, da es mit der Lichtbeugung im flachen Winkel zusammenhängt.
FSC hängt vom Zellvolumen ab, da es mit der Lichtbeugung im flachen Winkel zusammenhängt.
 SSC hingegen ein Maß für das Licht, das im rechten Winkel abgelenkt wird und gibt Auskunft über die Granularität des Zytoplasma, die Zahl der Vesikel sowie Struktur und Größe des Zellkerns.
SSC hingegen ein Maß für das Licht, das im rechten Winkel abgelenkt wird und gibt Auskunft über die Granularität des Zytoplasma, die Zahl der Vesikel sowie Struktur und Größe des Zellkerns.

 Abbildung: Durchflusszytometrische Karte von Leukozyten aus einer Blutprobe
Nach einer Vorlage in anth.ucsb.edu
Abbildung: Durchflusszytometrische Karte von Leukozyten aus einer Blutprobe
Nach einer Vorlage in anth.ucsb.edu
Durch
die Auffächerung nach zwei Kriterien der Durchflusszytometrie (Side scatter, Forward scatter) gelingt eine Zuordnung der Messpunkte auf verschiedene Zellgruppen
(Granulo-, Mono-, Lymphozyten), vgl. dort
Zusätzlich zur Lichtstreuung können auch Fluoreszenzfarben erfasst werden ( Abbildung oben). Diese binden entweder direkt an bestimmte Zellbestandteile - so markieren 4,6-Diamidin-2-phenylindol (DAPI) und Propidiumiodid DNA im Zellkern - oder man verwendet mit Fluoreszenzfarbstoffen markierte Antikörper,
die meist Membranproteine erkennen.
Abbildung oben). Diese binden entweder direkt an bestimmte Zellbestandteile - so markieren 4,6-Diamidin-2-phenylindol (DAPI) und Propidiumiodid DNA im Zellkern - oder man verwendet mit Fluoreszenzfarbstoffen markierte Antikörper,
die meist Membranproteine erkennen.
Verwendet man verschiedenfarbige Laser /
Filter, können mehrere Merkmale gleichzeitig quantifiziert werden.
Auf diese Weise kann z.B. eine
CD-Klassifizierung (CD = cluster of differentiation) erfolgen. Man kennt mittlerweile über 300 CD-Merkmale. Diese werden
spezifisch von bestimmten Zellen exprimiert und haben unterschiedliche
Funktionen. Die Analyse der Ausprägung diverser zellulärer Oberflächenmerkmale wird als Immunophenotyping bezeichnet.
 Externer Link: Liste von CD-Markern
Externer Link: Liste von CD-Markern
Die Durchflusszytometrie erlaubt durch computergesteuerte elektrische Aufladung der aus der vibrierenden Düse fallenden, jeweils eine definierte Zelle enthaltenden Tröpfchen die Separierung verschiedener Zellpopulationen aus einer Blutprobe. Negativ aufgeladene Tröpfchen werden Richtung Anode, positiv aufgeladene Richtung Kathode abgelenkt.
So können beispielsweise CD4+-Zellen und CD8+-Zellen in getrennte
Behälter aufgefangen und als definierte Zellpopulation weiter
untersucht bzw. verwendet werden.
Nachweis zellulärer Immunfunktionen
Die Evaluierung von Komponenten der zellulären Immunfunktionen (CMI: Cell-mediated immunity)
ist ein wesentlicher Bestandteil der Beurteilung des immunologischen
Abwehrpotenzials. Insbesondere kann das Risiko einer Immunotoxizität
durch z.B. CD8-positive Lymphozyten ermittelt werden (CTL-Assay).
Wie
kann man die Funktionstüchtigkeit einzelner Immunzellen unter
kontrollierten Bedingungen untersuchen und quantifizieren? In vivo ist
das kaum möglich, insbesondere, wenn definierte Versuchsbedingungen
vorliegen sollen. Aus Blut lassen sich Immunzellen leicht gewinnen,
aber es enthält ein breites Spektrum verschiedener Leukozyten, die man für in-vitro-Untersuchungen in separater Form benötigt.
Die Anwendung durchflusszytometrischer Verfahren erlaubt es, Leukozyten
separat aus einer Blutprobe zu gewinnen und dann zu untersuchen. Die
Funktionstüchtigkeit solcher definierter Immunzellen kann dann auf
verschiedene Weise getestet werden: Wie steht es um die Fähigkeit von
Phagozyten, mit Antigen oder Opsonin bedeckte
Partikel aufzunehmen? Wie intensiv sprechen Lymphozyten auf mitogene
oder auf spezifische Antigenreize an? Reagieren zytotoxische Zellen auf
spezifische pMHC-Reize mit Abtötung der Zielzellen?
Phagozytenfunktion
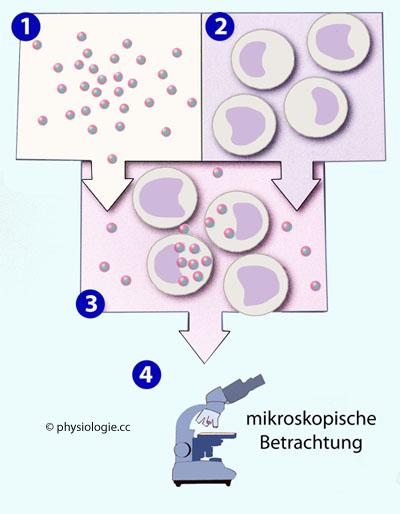

Abbildung: Prüfung der Phagozytenfunktion
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Optisch darstellbare, mit Opsoninen (Antigen oder Antikörper) bedeckte Partikel (1: Zellen, Bakterien, Latexpartikel) werden mit Phagozyten (2) inkubiert. Die Leukozyten phagozytieren einen Teil der Partikel (3). Die Auswertung (4) erfolgt mit dem Mikroskop

Wie
fit sind phagozytosefähige Leukozyten (Monozyten, neutrophile
Granulozyten..) in der Blutprobe einer Person, deren Immunfunktionen
untersucht werden sollen? Um dies zu testen, wird eine Gruppe
Leukozyten mit Korpuskeln (z.B. Latexpartikeln, Bakterien,
Erythrozyten) inkubiert, deren Oberfläche mit Opsoninen (die
Phagozytose anregenden Stoffen) bedeckt ist.
Anschließend kann man die Intensität der Phagozytose mikroskopisch
beurteilen (

Abbildung) oder die Aktivität von Enzymen messen,
welche die mit den Partikeln konfrontierten Zellen produzieren.
Proliferation von Lymphozyten, Monozyten, dendritischen Zellen
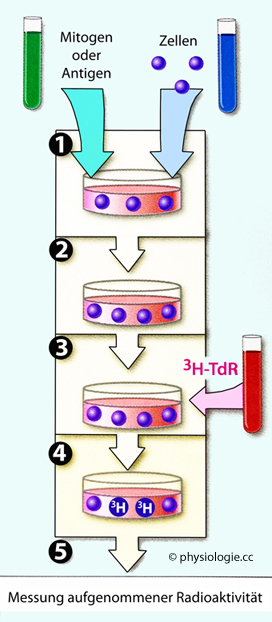
 Abbildung: Proliferationsassay
Abbildung: Proliferationsassay
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Dieser Versuchsansatz testet die Reaktionsfähigkeit mononukleärer Blutzellen auf einen Antigen- oder Mitogenreiz (1), der einer Zellkultur angeboten wird. Es folgt eine Inkubation für 24-72 Stunden Dauer (2). Anschließend wird ein markierter Nukleinsäure-Vorläufer zugegeben (3), z.B. Tritium-Thymidin (3H-TdR). Tritium ist ein Radionuklid, es emittiert Elektronen (ß-Strahlung).
Nach weiteren 18-24 Stunden Inkubation (4) ist der Marker in frisch aufgebaute DNA eingebaut, und die Radioaktivität ist ein Maß für die erfolgte Proliferation (5).

Man
kann auch untersuchen, wie mononukleäre Zellen sich teilen, wenn sie
entsprechend dazu angeregt werden. Für einen solchen Proliferationstest
werden Lymphozyten, Monozyten oder dendritische Zellen aus eine
Blutprobe isoliert (Zellsortierung s.
oben)
und für 2-3 Tage in eine Zellkultur verbracht. Ein nichtspezifisches
Mitogen wird zugesetzt, oder ein Antigen, gegen das die Person (von der
die Blutprobe stammt) sensibilisiert sein könnte.
Zur Darstellung können fluoreszierende Marker verwendet werden, wie
Carboxyfluorescein-Succinimidylester (CSFE), ein Stoff, der durch
Zellmembranen in das Zellinnere gelangt, sich kovalent an
intrazelluläre Moleküle bindet (hier stabil verbleibt) und nicht auf
Nachbarzellen verteilt. (CSFE kann auch dazu verwendet werden, den Weg
markierter Lymphozyten durch den Organismus über Monate zu verfolgen.)
Teilen sich die Zellen, wird dieser Marker je Zelle "verdünnt" (pro
Mitose jeweils auf die Hälfte), indem er auf die Tochterzellen
aufgeteilt wird. Auf diese Weise kann man 7-8 Mitosen nachweisen, bevor
durch die Verdünnung des Markes die für den Nachweis notwendige Aktivität zu gering geworden ist.
Zytotoxischer T-Zellen- Assay
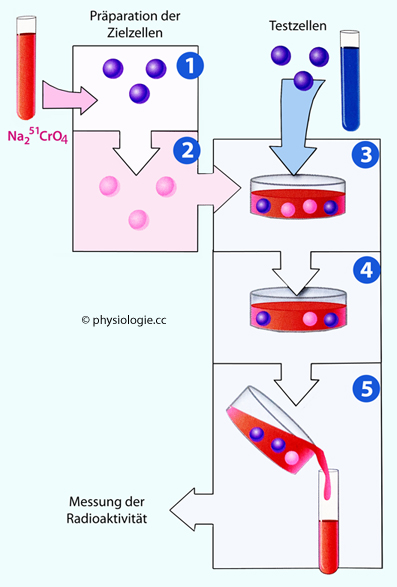
 Abbildung: Chrom-Freisetzungsassay
Abbildung: Chrom-Freisetzungsassay
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Mit diesem Test kann die Funktion zytotoxischer T-Zellen (CTL), natürlicher Killerzellen (NK) und NKT-Zellen untersucht werden.
Die Zielzellen werden mit einem radioaktiven Schwermetall inkubiert (1), das an Proteine im Zytoplasma bindet (2
- Radioaktivität in Zellen rot angedeutet). Testzellen
(=Effektorzellen) werden mit den markierten Zellen mit verschiedenem
Zahlenverhältnis Effektorzellen / Zielzellen inkubiert (3).
Wenn vorhanden, lysieren CTL, NK oder NKT-Zellen die Zielzellen, was Radioaktivität in das Medium freisetzt (4). Anschließend wird die Radioaktivität im (zellfreien) Medium - hier als rote Flüssigkeit dargestellt - gemessen (5)

CD8-positive Lymphozyten (Killerzellen)
lysieren ihre Zielzellen (Zellen, die entsprechende Fremdepitope über
ihre MHC-I-Moleküle präsentieren). Ihre Aktivität kommt im klassischen
Versuchsaufbau (

Abbildung) im Ausmaß der Radioaktivität zum
Ausdruck, die nach der Freisetzung des markierten Zytosols aus den
lysierten Zellen in der Flüssigkeit des Inkubationsmediums nachweisbar
wird.
Neuere Methoden nutzen das
Apoptosesystem (Caspase-3-Spaltprodukte werden durch Antikörper erkannt) und
Immunfluoreszenz. Auch auf diese Weise kann man die lytische Aktivität von
CD8
+-, natürlichen Killer- sowie von NKT-Zellen ermitteln.


 Verdacht auf immunpathologische Abweichungen besteht bei auffälliger
Anamnese, häufig auftretenden Infekten, schwachem Impfschutz,
reduziertem lymphatischen Status, ungewöhnlichen Infekten,
Autoimmungeschehen
Verdacht auf immunpathologische Abweichungen besteht bei auffälliger
Anamnese, häufig auftretenden Infekten, schwachem Impfschutz,
reduziertem lymphatischen Status, ungewöhnlichen Infekten,
Autoimmungeschehen
 Immunkompetenz läßt sich anhand vielfacher Indikatoren abschätzen:
Differenzialblutbild, Komplementfaktoren, HLA, zelluläre / humorale
lymphatische Funktionen, Zytokinstatus
Immunkompetenz läßt sich anhand vielfacher Indikatoren abschätzen:
Differenzialblutbild, Komplementfaktoren, HLA, zelluläre / humorale
lymphatische Funktionen, Zytokinstatus
 Spezifische Erkennung von in Lösung
befindlichen Epitopen erfolgt durch Antikörper (Agglutinationstests,
Immundiffusionstest, Immunelektrophorese, Western blotting,
Radioimmunoassay, ELISA, Fluoreszenz-Immunosorbent Assay). Immunoassays umfassen Radioimmunoassay (RIA),
Festphasen-Enzym-Immunosorbent-Assays (EIA), Enzyme Linked
Immunosorbent Assay (ELISA) Spezifische Erkennung von in Lösung
befindlichen Epitopen erfolgt durch Antikörper (Agglutinationstests,
Immundiffusionstest, Immunelektrophorese, Western blotting,
Radioimmunoassay, ELISA, Fluoreszenz-Immunosorbent Assay). Immunoassays umfassen Radioimmunoassay (RIA),
Festphasen-Enzym-Immunosorbent-Assays (EIA), Enzyme Linked
Immunosorbent Assay (ELISA)
 Epitope auf oder in Zellen werden z.B. durch Immunfluoreszenz oder
Durchflusszytometrie erfasst. Epitope auf oder in Zellen werden z.B. durch Immunfluoreszenz oder
Durchflusszytometrie erfasst.
Die Funktionstüchtigkeit
isolierter Immunzellen kann über die Intensität der Phagozytose, Proliferation, oder Zytolyse bestimmt werden
 Durchflusszytometrie erfasst Charakteristika einzelner Zellen über
optische oder elektrische Detektion; die Signale korrelieren mit Größe
und Strukturmerkmalen der Zellen: Beispielsweise Vorwärtsstreulicht
(FSC = Forward Scatter) mit dem Zellvolumen, Seitwärtsstreulicht (SSC =
Side Scatter) mit der Granularität des Zytoplasma, der Zahl der
Vesikel, Struktur und Größe des Zellkerns Durchflusszytometrie erfasst Charakteristika einzelner Zellen über
optische oder elektrische Detektion; die Signale korrelieren mit Größe
und Strukturmerkmalen der Zellen: Beispielsweise Vorwärtsstreulicht
(FSC = Forward Scatter) mit dem Zellvolumen, Seitwärtsstreulicht (SSC =
Side Scatter) mit der Granularität des Zytoplasma, der Zahl der
Vesikel, Struktur und Größe des Zellkerns
 Auch CD-Klassifizierungen sind mit solchen Methoden möglich (Immunophenotyping) Auch CD-Klassifizierungen sind mit solchen Methoden möglich (Immunophenotyping)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Abszess: abs-cedere = sich zurückziehen, weichen (abscessus = Eitergeschwulst)
Abszess: abs-cedere = sich zurückziehen, weichen (abscessus = Eitergeschwulst) Labormethoden
Labormethoden  Nachweis zellulärer Immunfunktionen
Nachweis zellulärer Immunfunktionen
 Anamnese und Befund auffällig sind (z.B. Hautbefunde wie Pyodermie
Anamnese und Befund auffällig sind (z.B. Hautbefunde wie Pyodermie  , schwere Abszesse
, schwere Abszesse  , Alopezie
, Alopezie  )
) Infektionen mit auffälliger Häufigkeit auftreten
Infektionen mit auffälliger Häufigkeit auftreten Erreger im Spiel sind, gegen die eigentlich ein Impfschutz vorliegen sollte
Erreger im Spiel sind, gegen die eigentlich ein Impfschutz vorliegen sollte Lymphatisches Gewebe reduziert ist (mangelnde Ausbildung / Reaktion von Lymphknoten, Fehlen von Tonsillen, Thymus,..)
Lymphatisches Gewebe reduziert ist (mangelnde Ausbildung / Reaktion von Lymphknoten, Fehlen von Tonsillen, Thymus,..) Ungewöhnliche (insbesondere opportunistische) Keime im Vordergrund stehen (die normalerweise nicht exazerbieren)
Ungewöhnliche (insbesondere opportunistische) Keime im Vordergrund stehen (die normalerweise nicht exazerbieren) Infektionen auffällig verlaufen (z.B. in den Nebenhöhlen, Mundsoor - Kandidose -, Osteomyelitiden
Infektionen auffällig verlaufen (z.B. in den Nebenhöhlen, Mundsoor - Kandidose -, Osteomyelitiden  usw.)
usw.) Autoimmungeschehen auftreten
Autoimmungeschehen auftreten Allgemein:
Allgemein: Differenzialblutbild (Neutropenie? Lymphopenie?)
Differenzialblutbild (Neutropenie? Lymphopenie?) Immunglobuline
Immunglobuline  Komplementfaktoren (Komplementdefekt?)
Komplementfaktoren (Komplementdefekt?) HLA-Typisierung
HLA-Typisierung  In-vivo-Assays. Testungen auf Allergien s. dort
In-vivo-Assays. Testungen auf Allergien s. dort Weiterführend:
Weiterführend: Phagozyten.
Die Fähigkeit von Phagozyten, antigenbeladene Partikel (Latexkügelchen,
Zellen, Bakterien) aufzunehmen, wird unter dem Mikroskop untersucht und
spiegelt ihre Funktionstüchtigkeit wider.
Phagozyten.
Die Fähigkeit von Phagozyten, antigenbeladene Partikel (Latexkügelchen,
Zellen, Bakterien) aufzunehmen, wird unter dem Mikroskop untersucht und
spiegelt ihre Funktionstüchtigkeit wider.  Proliferation mononukleärer Zellen: Lymphozyten, Monozyten oder dendritische Zellen
werden isoliert und für 2-3 Tage in eine Gewebekultur verbracht. Dann
wird ein Antigen (welchem die untersuchte Person möglicherweise
ausgesetzt war) und seine Aufnahme durch die mononukleären Zellen
bestimmt.
Proliferation mononukleärer Zellen: Lymphozyten, Monozyten oder dendritische Zellen
werden isoliert und für 2-3 Tage in eine Gewebekultur verbracht. Dann
wird ein Antigen (welchem die untersuchte Person möglicherweise
ausgesetzt war) und seine Aufnahme durch die mononukleären Zellen
bestimmt.  T-Zell-System (In-vitro-Funktion, Immunphänotypisierung; T-Zell-Defekt?)
T-Zell-System (In-vitro-Funktion, Immunphänotypisierung; T-Zell-Defekt?) B-Zell-System (in vivo, in vitro; humoraler Immundefekt?)
B-Zell-System (in vivo, in vitro; humoraler Immundefekt?) Zytokine (z.B. IL-6 <11,3 ng/l, IL-8 <62 ng/l, TNF-α <8 ng/l)
Zytokine (z.B. IL-6 <11,3 ng/l, IL-8 <62 ng/l, TNF-α <8 ng/l) T-Lymphozyten
T-Lymphozyten B-Lymphozyten
B-Lymphozyten NK-Zellen
NK-Zellen Diffusion, Immunelektrophorese
Diffusion, Immunelektrophorese  Immunoassays
Immunoassays  Immunfluoreszenz
Immunfluoreszenz  Durchflusszytometrie
Durchflusszytometrie Abbildung):
Abbildung):
 Abbildung: Bestimmung des Antikörpertiters
Abbildung: Bestimmung des Antikörpertiters
 Abbildung).
Abbildung).
 Abbildung: Indirekte (passive) Agglutinationsreaktion
Abbildung: Indirekte (passive) Agglutinationsreaktion

 Abbildung: Immunelektrophorese
Abbildung: Immunelektrophorese
 Abbildung). Ein Antigengemisch wird zuerst elektrophoretisch
in mehrere Komponenten aufgetrennt, und die entstandenen Fraktionen
diffundieren in der Folge gegen eine "Front" von Antikörpern.
Abbildung). Ein Antigengemisch wird zuerst elektrophoretisch
in mehrere Komponenten aufgetrennt, und die entstandenen Fraktionen
diffundieren in der Folge gegen eine "Front" von Antikörpern.  s. dort).
s. dort). Radioimmunassay (RIA): Quantitativer Nachweis von Infektionsantigenen im Blut. Direkte (direct RIA) oder indirekte (indirect RIA)
Antikörper (vgl. oben) können eingesetzt werden, wegen der
Strahlenbelastung des Laborpersonals sowie unvermeidlichen
Entsorgungsproblemen (radioaktiver Abfall) werden RIAs nur noch selten
verwendet.
Radioimmunassay (RIA): Quantitativer Nachweis von Infektionsantigenen im Blut. Direkte (direct RIA) oder indirekte (indirect RIA)
Antikörper (vgl. oben) können eingesetzt werden, wegen der
Strahlenbelastung des Laborpersonals sowie unvermeidlichen
Entsorgungsproblemen (radioaktiver Abfall) werden RIAs nur noch selten
verwendet.

 Enzyme Linked Immunosorbent Assay
(ELISA): Nachweis von Proteinen, z.B. Antikörpern, Viren. Dieser Test
hat weitgehend Radioimmunoassays (RIA) ersetzt - er ist sicher, der
Zeitaufwand für seine Durchführung gering, die Reagenzien sind relativ
stabil und die Sensitivität übertrifft teilseise die eines RIA. ELISAs
sind spezifisch und quantitativ.
Enzyme Linked Immunosorbent Assay
(ELISA): Nachweis von Proteinen, z.B. Antikörpern, Viren. Dieser Test
hat weitgehend Radioimmunoassays (RIA) ersetzt - er ist sicher, der
Zeitaufwand für seine Durchführung gering, die Reagenzien sind relativ
stabil und die Sensitivität übertrifft teilseise die eines RIA. ELISAs
sind spezifisch und quantitativ. Ein Fluorescent immunosorbent Assay
(FIA) verwendet fluoreszierende Marker
(FITC:
Fluorescein-Isothiocyanat, PE: Phycoerythrin). Diese leuchten kurz nach
Anregung durch Licht auf (meist mit Photonen geringerer Energie als das
der Anregung; als Fluorophor bezeichnet man ein System, das Fluoreszenz erkennen läßt; Fluorochrome bzw. Fluoreszenzfarbstoffe sind für Färbungen verwendete fluoreszierende Substanzen).
Ein Fluorescent immunosorbent Assay
(FIA) verwendet fluoreszierende Marker
(FITC:
Fluorescein-Isothiocyanat, PE: Phycoerythrin). Diese leuchten kurz nach
Anregung durch Licht auf (meist mit Photonen geringerer Energie als das
der Anregung; als Fluorophor bezeichnet man ein System, das Fluoreszenz erkennen läßt; Fluorochrome bzw. Fluoreszenzfarbstoffe sind für Färbungen verwendete fluoreszierende Substanzen).
 Abbildung: Immunfluoreszenz (IF)
Abbildung: Immunfluoreszenz (IF)

 Abbildung: Immunophenotyping
Abbildung: Immunophenotyping
 Abbildung):
Abbildung):  FSC hängt vom Zellvolumen ab, da es mit der Lichtbeugung im flachen Winkel zusammenhängt.
FSC hängt vom Zellvolumen ab, da es mit der Lichtbeugung im flachen Winkel zusammenhängt.  SSC hingegen ein Maß für das Licht, das im rechten Winkel abgelenkt wird und gibt Auskunft über die Granularität des Zytoplasma, die Zahl der Vesikel sowie Struktur und Größe des Zellkerns.
SSC hingegen ein Maß für das Licht, das im rechten Winkel abgelenkt wird und gibt Auskunft über die Granularität des Zytoplasma, die Zahl der Vesikel sowie Struktur und Größe des Zellkerns. 
 Abbildung: Durchflusszytometrische Karte von Leukozyten aus einer Blutprobe
Abbildung: Durchflusszytometrische Karte von Leukozyten aus einer Blutprobe
 Abbildung oben). Diese binden entweder direkt an bestimmte Zellbestandteile - so markieren 4,6-Diamidin-2-phenylindol (DAPI) und Propidiumiodid DNA im Zellkern - oder man verwendet mit Fluoreszenzfarbstoffen markierte Antikörper,
die meist Membranproteine erkennen.
Abbildung oben). Diese binden entweder direkt an bestimmte Zellbestandteile - so markieren 4,6-Diamidin-2-phenylindol (DAPI) und Propidiumiodid DNA im Zellkern - oder man verwendet mit Fluoreszenzfarbstoffen markierte Antikörper,
die meist Membranproteine erkennen.  Externer Link: Liste von CD-Markern
Externer Link: Liste von CD-Markern
 Abbildung: Prüfung der Phagozytenfunktion
Abbildung: Prüfung der Phagozytenfunktion
 Abbildung) oder die Aktivität von Enzymen messen,
welche die mit den Partikeln konfrontierten Zellen produzieren.
Abbildung) oder die Aktivität von Enzymen messen,
welche die mit den Partikeln konfrontierten Zellen produzieren.
 Abbildung: Proliferationsassay
Abbildung: Proliferationsassay

 Abbildung: Chrom-Freisetzungsassay
Abbildung: Chrom-Freisetzungsassay
 Abbildung) im Ausmaß der Radioaktivität zum
Ausdruck, die nach der Freisetzung des markierten Zytosols aus den
lysierten Zellen in der Flüssigkeit des Inkubationsmediums nachweisbar
wird.
Abbildung) im Ausmaß der Radioaktivität zum
Ausdruck, die nach der Freisetzung des markierten Zytosols aus den
lysierten Zellen in der Flüssigkeit des Inkubationsmediums nachweisbar
wird.
 Verdacht auf immunpathologische Abweichungen besteht bei auffälliger
Anamnese, häufig auftretenden Infekten, schwachem Impfschutz,
reduziertem lymphatischen Status, ungewöhnlichen Infekten,
Autoimmungeschehen
Verdacht auf immunpathologische Abweichungen besteht bei auffälliger
Anamnese, häufig auftretenden Infekten, schwachem Impfschutz,
reduziertem lymphatischen Status, ungewöhnlichen Infekten,
Autoimmungeschehen Immunkompetenz läßt sich anhand vielfacher Indikatoren abschätzen:
Differenzialblutbild, Komplementfaktoren, HLA, zelluläre / humorale
lymphatische Funktionen, Zytokinstatus
Immunkompetenz läßt sich anhand vielfacher Indikatoren abschätzen:
Differenzialblutbild, Komplementfaktoren, HLA, zelluläre / humorale
lymphatische Funktionen, Zytokinstatus Spezifische Erkennung von in Lösung
befindlichen Epitopen erfolgt durch Antikörper (Agglutinationstests,
Immundiffusionstest, Immunelektrophorese, Western blotting,
Radioimmunoassay, ELISA, Fluoreszenz-Immunosorbent Assay). Immunoassays umfassen Radioimmunoassay (RIA),
Festphasen-Enzym-Immunosorbent-Assays (EIA), Enzyme Linked
Immunosorbent Assay (ELISA)
Spezifische Erkennung von in Lösung
befindlichen Epitopen erfolgt durch Antikörper (Agglutinationstests,
Immundiffusionstest, Immunelektrophorese, Western blotting,
Radioimmunoassay, ELISA, Fluoreszenz-Immunosorbent Assay). Immunoassays umfassen Radioimmunoassay (RIA),
Festphasen-Enzym-Immunosorbent-Assays (EIA), Enzyme Linked
Immunosorbent Assay (ELISA) Epitope auf oder in Zellen werden z.B. durch Immunfluoreszenz oder
Durchflusszytometrie erfasst.
Epitope auf oder in Zellen werden z.B. durch Immunfluoreszenz oder
Durchflusszytometrie erfasst. Durchflusszytometrie erfasst Charakteristika einzelner Zellen über
optische oder elektrische Detektion; die Signale korrelieren mit Größe
und Strukturmerkmalen der Zellen: Beispielsweise Vorwärtsstreulicht
(FSC = Forward Scatter) mit dem Zellvolumen, Seitwärtsstreulicht (SSC =
Side Scatter) mit der Granularität des Zytoplasma, der Zahl der
Vesikel, Struktur und Größe des Zellkerns
Durchflusszytometrie erfasst Charakteristika einzelner Zellen über
optische oder elektrische Detektion; die Signale korrelieren mit Größe
und Strukturmerkmalen der Zellen: Beispielsweise Vorwärtsstreulicht
(FSC = Forward Scatter) mit dem Zellvolumen, Seitwärtsstreulicht (SSC =
Side Scatter) mit der Granularität des Zytoplasma, der Zahl der
Vesikel, Struktur und Größe des Zellkerns Auch CD-Klassifizierungen sind mit solchen Methoden möglich (Immunophenotyping)
Auch CD-Klassifizierungen sind mit solchen Methoden möglich (Immunophenotyping)