




| Der Knochen ist nicht nur Stützorgan und Mineralspeicher, sondern auch mechanosensibel und insoferne ein Sinnesorgan. Mechanische Belastung des Knochens verschiebt extrazelluläre Flüssigkeit in den Knochenkanälchen, das erzeugt Scherkräfte (shear stress), die sich auf die Osteozyten übertragen. Diese - netzartig verzweigten und untereinander verbundenen - Zellen sind Mechanosensoren: Sie nehmen physikalische Reize auf und setzen sie in molekulare Antworten um (z.B. Hemmung der Sclerostinsynthese). Je höher die auftretenden (Spitzen-)Kräfte, desto stärker wird die Anlagerung neuer Knochenmasse gefördert; das Knochengewebe wird dadurch belastungsfähiger und bruchfester. Bleiben solche mechanischen Belastungen aus, überwiegt der Abbauprozess (Inaktivitätsatrophie, Osteoporose). Diese Anpassung an die mechanische Belastung erfolgt unabhängig von systemischen Einflüssen wie Parathormon oder Vitamin D. Osteoprotegerin (ein Produkt der Osteoblasten) bindet an den Osteoklasten-Rezeptor RANKL und schützt so den Knochen vor Abbau. Glucocorticoide hingegen hemmen die Bildung von Osteoprotegerin, stimulieren diejenige von RANKL, und fördern dadurch den Knochenumbau. |
 Steuerung von Osteogenese und Knochenabbau
Steuerung von Osteogenese und Knochenabbau  Knochen und Calcium
Knochen und Calcium
 Core messages
Core messages Abbildung).
Abbildung). 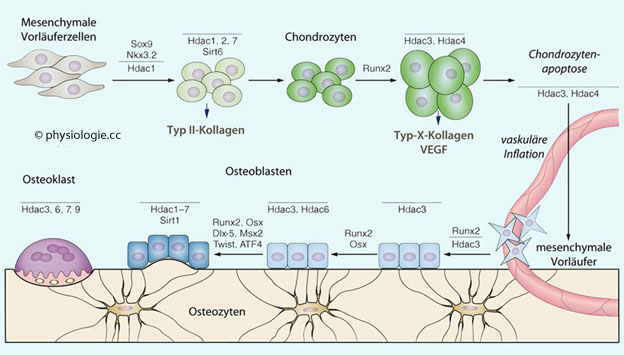
 Abbildung: Ossifikation, Knochenauf- und abbau, und ihre Steuerungsfaktoren
Abbildung: Ossifikation, Knochenauf- und abbau, und ihre Steuerungsfaktoren
 Abbildung) und wird als intussuszeptionelles Wachstum bezeichnet. Die Anlagerung neuer Knorpelsubstanz von außen her nennt man appositionell: Diese geht von sich mitotisch teilenden Chondroblasten der Knorpeloberfläche aus, kann auch nach dem Schluss der Epiphysenfugen erfolgen, verkalken und zu Verdickung von Knochen führen.
Abbildung) und wird als intussuszeptionelles Wachstum bezeichnet. Die Anlagerung neuer Knorpelsubstanz von außen her nennt man appositionell: Diese geht von sich mitotisch teilenden Chondroblasten der Knorpeloberfläche aus, kann auch nach dem Schluss der Epiphysenfugen erfolgen, verkalken und zu Verdickung von Knochen führen.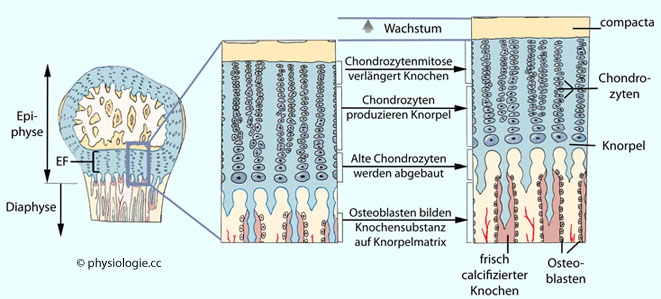
 Abbildung: Längenwachstum in einem Röhrenknochen
Abbildung: Längenwachstum in einem Röhrenknochen ,
epiphysis ossis). Jeweils eine solche (nicht scharf abgrenzbare)
Übergangszone befindet sich an den Enden des Langknochens, wird auch
als Metaphyse bezeichnet und enthält die Epiphysenfuge (EF).
,
epiphysis ossis). Jeweils eine solche (nicht scharf abgrenzbare)
Übergangszone befindet sich an den Enden des Langknochens, wird auch
als Metaphyse bezeichnet und enthält die Epiphysenfuge (EF). 
 -Ligand spielt eine Schlüsselrolle für die Reifung und Aktivierung der Osteoklasten (Abbildungen). Osteoprotegerin
-Ligand spielt eine Schlüsselrolle für die Reifung und Aktivierung der Osteoklasten (Abbildungen). Osteoprotegerin  (ein Produkt von Osteoblasten) bindet an RANKL und schützt so den Knochen vor Abbau. Glucocorticoide
wirken umgekehrt: Sie hemmen die Bildung von Osteoprotegerin und
stimulieren diejenige von RANKL, fördern dadurch den Knochenabbau.
(ein Produkt von Osteoblasten) bindet an RANKL und schützt so den Knochen vor Abbau. Glucocorticoide
wirken umgekehrt: Sie hemmen die Bildung von Osteoprotegerin und
stimulieren diejenige von RANKL, fördern dadurch den Knochenabbau. 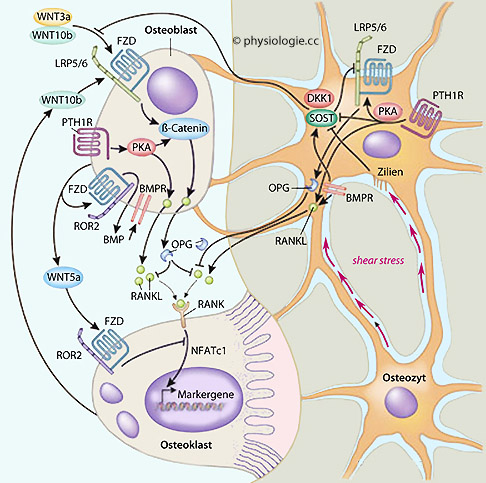
 Abbildung: Detektion mechanischer Belastung im Knochen (rechts) und Regulation der Blasten-Klasten-Kooperation (links)
Abbildung: Detektion mechanischer Belastung im Knochen (rechts) und Regulation der Blasten-Klasten-Kooperation (links) DKK1, Dickkopf-related protein 1, zysteinreiches Knochenprotein
DKK1, Dickkopf-related protein 1, zysteinreiches Knochenprotein  FZD, Frizzled protein (D nach drosophila), Rezeptorprotein mit zahlreichen Funktionen
FZD, Frizzled protein (D nach drosophila), Rezeptorprotein mit zahlreichen Funktionen  LRP5, Low-density lipoprotein receptor-related protein 5 - ein LDL-Rezeptor, der rezeptormediiert endozytiert
LRP5, Low-density lipoprotein receptor-related protein 5 - ein LDL-Rezeptor, der rezeptormediiert endozytiert  NFAT, Nuclear factor of activated T-cells, T-lymphozytäre Transkriptionsfaktor, der aktiviert an einen Promotor bindet und die Genexpression von Zytokinen anregt
NFAT, Nuclear factor of activated T-cells, T-lymphozytäre Transkriptionsfaktor, der aktiviert an einen Promotor bindet und die Genexpression von Zytokinen anregt  PKA, Proteinkinase A
PKA, Proteinkinase A  RANK, Receptor activator of nuclear factor kappa B - ein Protein der Membran von
Osteoklasten, das deren Aktivierung durch Bindung von Liganden
beeinflusst - Mutationen führen zu Knochenerkrankungen
RANK, Receptor activator of nuclear factor kappa B - ein Protein der Membran von
Osteoklasten, das deren Aktivierung durch Bindung von Liganden
beeinflusst - Mutationen führen zu Knochenerkrankungen  RANKL, RANK-Ligand (die Bindung an RANK führt zur Differenzierung von Klasten - vgl. dort)
RANKL, RANK-Ligand (die Bindung an RANK führt zur Differenzierung von Klasten - vgl. dort)  ROR2, Receptor tyrosine kinase-like orphan receptor, transmembranaler Rezeptor, Tyrosin-Proteinkinase, regt das Wachstum in Epiphysenfugen an
ROR2, Receptor tyrosine kinase-like orphan receptor, transmembranaler Rezeptor, Tyrosin-Proteinkinase, regt das Wachstum in Epiphysenfugen an  SOST, Gen für Sclerostin, hemmt Knochenformation durch Osteoblasten
SOST, Gen für Sclerostin, hemmt Knochenformation durch Osteoblasten  WNT, Protoonkogen. Die WNT-Genfamilie codiert Signalproteine
WNT, Protoonkogen. Die WNT-Genfamilie codiert Signalproteine
 Abbildung). Diese
Flüssigkeitsströmung reizt (shear stress) Rezeptoren in der Zellmembran von Osteozyten, die in den Kanälchen ein Netzwerk bilden (vergleichbar der Scherspannung in Blutgefäßen, die Endothelzellen reizt).
Abbildung). Diese
Flüssigkeitsströmung reizt (shear stress) Rezeptoren in der Zellmembran von Osteozyten, die in den Kanälchen ein Netzwerk bilden (vergleichbar der Scherspannung in Blutgefäßen, die Endothelzellen reizt).  Physiologische Anpassung der Knochenmasse an das Belastungsmuster:
Der Knochen unterliegt fortlaufender Umformung (remodeling).
Vermehrte Scherspannung im Knochen fördert seine Neubildung (z.B.
infolge Krafttraining), verminderte Reizung hingegen führt zu Abbau der
Knochensubstanz (z.B. infolge Immobilisierung). Die Belastung steuert
den Knochenstatus primär: Je höher die auftretenden (Spitzen-)Kräfte,
desto belastungsfähiger (und bruchfester) wird das Gewebe. (Das gilt
bis zur physiologischen Belastungsgrenze - z.B. beim Femurknochen bis
zu 1,6 Tonnen).
Physiologische Anpassung der Knochenmasse an das Belastungsmuster:
Der Knochen unterliegt fortlaufender Umformung (remodeling).
Vermehrte Scherspannung im Knochen fördert seine Neubildung (z.B.
infolge Krafttraining), verminderte Reizung hingegen führt zu Abbau der
Knochensubstanz (z.B. infolge Immobilisierung). Die Belastung steuert
den Knochenstatus primär: Je höher die auftretenden (Spitzen-)Kräfte,
desto belastungsfähiger (und bruchfester) wird das Gewebe. (Das gilt
bis zur physiologischen Belastungsgrenze - z.B. beim Femurknochen bis
zu 1,6 Tonnen). 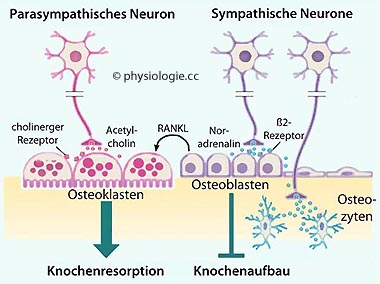
 Abbildung: Mögliche Mechanismen, wie der Sympathikus Knochenabbau fördert und Knochenneubildung hemmt
Abbildung: Mögliche Mechanismen, wie der Sympathikus Knochenabbau fördert und Knochenneubildung hemmt
 Adrenerger Einfluss: Der Sympathikus wirkt auf den Knochenstoffwechsel. Knochenzellen (Osteoblasten,
Osteozyten, Osteoklasten) weisen in ihrer Membran α- und ß-Rezeptoren auf; vor allem
über letztere wird via vermehrte RANKL-Bildung das Knochenwachstum
gebremst, der Abbau gefördert (
Adrenerger Einfluss: Der Sympathikus wirkt auf den Knochenstoffwechsel. Knochenzellen (Osteoblasten,
Osteozyten, Osteoklasten) weisen in ihrer Membran α- und ß-Rezeptoren auf; vor allem
über letztere wird via vermehrte RANKL-Bildung das Knochenwachstum
gebremst, der Abbau gefördert ( Abbildung).
Abbildung).  Cholinerger Einfluss: Acetylcholinrezeptoren
auf Osteoklasten und Osteoblasten wirken vermutlich anabol.
Cholinerger Einfluss: Acetylcholinrezeptoren
auf Osteoklasten und Osteoblasten wirken vermutlich anabol. 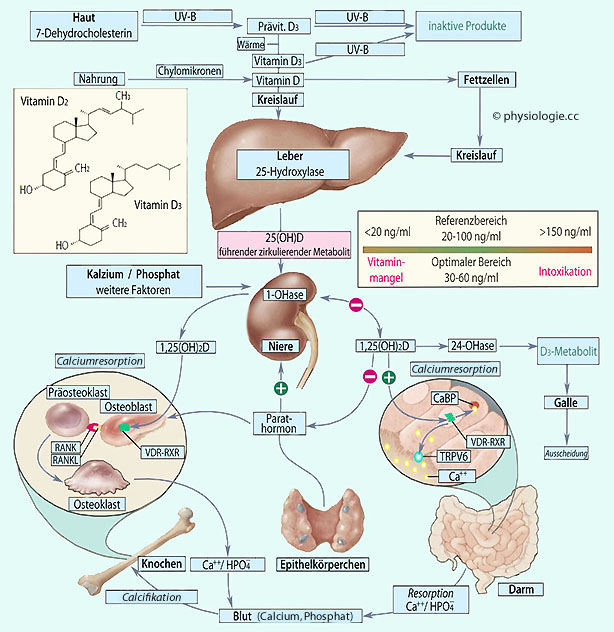
 Abbildung: Calciummetabolismus und Knochen
Abbildung: Calciummetabolismus und Knochen VDR, Vitamin D-Rezeptor
VDR, Vitamin D-Rezeptor  RXR, Retinoid X-Rezeptor
RXR, Retinoid X-Rezeptor  RANK(L) s. dort
RANK(L) s. dort  TRPV6, Calcium-resorbierender TRP-Kanal
TRPV6, Calcium-resorbierender TRP-Kanal
 s. dort).
s. dort). Mechanische Belastung des Knochens (körperliche Aktivität)
Mechanische Belastung des Knochens (körperliche Aktivität) Endokriner Status (Geschlechtshormone)
Endokriner Status (Geschlechtshormone) Calciumaufnahme (Ernährung)
Calciumaufnahme (Ernährung)
 Über die Veränderung der Knochendichte mit dem Lebensalter s. auch dort
Über die Veränderung der Knochendichte mit dem Lebensalter s. auch dort Photonen-Absorptiometrie (Single
photon absorptiometry SPA, Dual photon absorptiometry DPA),
Photonen-Absorptiometrie (Single
photon absorptiometry SPA, Dual photon absorptiometry DPA), 
 Röntgenanalyse (Absorptiometrie DEXA: Dual-energy X-ray absorptiometry, Radiogrammetrie DXR: Digital X-ray radiogrammetry).
Röntgenanalyse (Absorptiometrie DEXA: Dual-energy X-ray absorptiometry, Radiogrammetrie DXR: Digital X-ray radiogrammetry).  spricht man, wenn das Messresultat unter dem 2,5-fachen Standardabweichungsbereich einer Referenzpopulation liegt.
spricht man, wenn das Messresultat unter dem 2,5-fachen Standardabweichungsbereich einer Referenzpopulation liegt.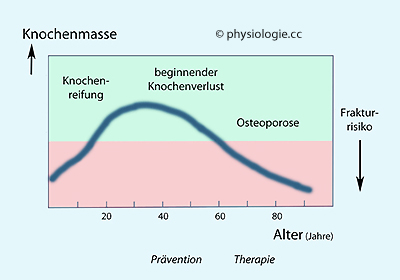
 Abbildung: Knochenmasse und
Frakturrisiko mit dem Lebensalter
Abbildung: Knochenmasse und
Frakturrisiko mit dem Lebensalter



 die Schallgeschwindigkeit
(abhängig von mechanischen
Eigenschaften und Größe des Knochens sowie Schallweg) und / oder
die Schallgeschwindigkeit
(abhängig von mechanischen
Eigenschaften und Größe des Knochens sowie Schallweg) und / oder die Abschwächung des Signals
im Durchschallungsverfahren (
die Abschwächung des Signals
im Durchschallungsverfahren ( Abbildung).
Abbildung).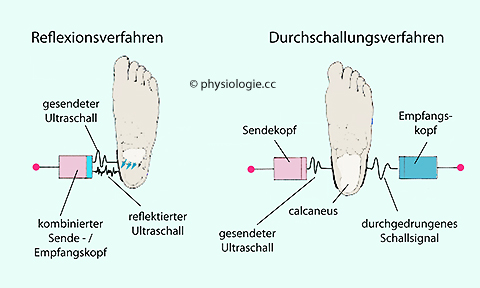
 Abbildung: Bestimmung physikalischer
Knocheneigenschaften mittels Ultraschall
Abbildung: Bestimmung physikalischer
Knocheneigenschaften mittels Ultraschall
 Röntgen: Standardmethode, zeigt z.T. unspezifisch Demineralisierung des Knochen an (verringerte Dichte)
Röntgen: Standardmethode, zeigt z.T. unspezifisch Demineralisierung des Knochen an (verringerte Dichte) Szintigrafie: Darstellung von Regionen mit gesteigertem Knochenumbau mit radioaktivem Marker (Biphosphonat mit 99m-Technecium)
Szintigrafie: Darstellung von Regionen mit gesteigertem Knochenumbau mit radioaktivem Marker (Biphosphonat mit 99m-Technecium) Computertomographie (CT): Nachweis intraossärer Strukturen und veränderter Knochenkonturen. Quantitative CT erlaubt die Abschätzung der Knochendichte bzw. -masse
Computertomographie (CT): Nachweis intraossärer Strukturen und veränderter Knochenkonturen. Quantitative CT erlaubt die Abschätzung der Knochendichte bzw. -masse Magnetresonanztomografie (MRT): Nachweis von Weichteilgewebe (Metastasen)
Magnetresonanztomografie (MRT): Nachweis von Weichteilgewebe (Metastasen) Single-photon
absorptiometry: Photonen-Absorptiometrie; ein radioaktives Nuklid
(Photonen-Emitter) wird über den zu testenden Knochen (z.B.
Radius) geführt und auf der Gegenseite die Strahlungsintensität
detektiert. Die Absorption wird auf g/cm
kalibriert. Die Methode eignet sich für Knochen, die nur von
wenig Weichgewebe umgeben sind
Single-photon
absorptiometry: Photonen-Absorptiometrie; ein radioaktives Nuklid
(Photonen-Emitter) wird über den zu testenden Knochen (z.B.
Radius) geführt und auf der Gegenseite die Strahlungsintensität
detektiert. Die Absorption wird auf g/cm
kalibriert. Die Methode eignet sich für Knochen, die nur von
wenig Weichgewebe umgeben sind Dual-energy
absorptiometry: Zwei-Energie-Röntgentechnik, verwendet zwei unterschiedliche
Strahlungsintensitäten. Methode der Wahl zur Knochendichtebestimmung
Dual-energy
absorptiometry: Zwei-Energie-Röntgentechnik, verwendet zwei unterschiedliche
Strahlungsintensitäten. Methode der Wahl zur Knochendichtebestimmung Dual photon absorptiometry DPA: Gadolinium-153 (emittiert
Gammastrahlung mit 44 und 100 keV)
Dual photon absorptiometry DPA: Gadolinium-153 (emittiert
Gammastrahlung mit 44 und 100 keV)  Dual-energy X-ray absorptiometry DEXA, Radiogrammetrie DXR: Röntgenstrahlung mit zwei
Intensitäten
Dual-energy X-ray absorptiometry DEXA, Radiogrammetrie DXR: Röntgenstrahlung mit zwei
Intensitäten Bei diesem - höhere Energiedosen verwendenden - Verfahren werden die Gewebe unterschiedlicher Dichte besser durchdrungen, und es können auch z.B. Wirbel und Hüftapparat gut dargestellt werden.

Zu Knochenmarkern s. dort

 Knochenumsatz (remodeling):
Osteoklasten lagern sich mittels Integrinen an das
Glykoprotein Vitronektin der Knochenmatrix an, bilden eine am Rand
abgedichtete Resorptionslakune und sezernieren Protonen und saure
Proteasen, die den mineralischen Knochen bzw. Matrixproteine auflösen.
Osteoblasten füllen die Lakune mit neuer Knochensubstanz auf; sie
bilden Osteoprotegerin, dieses bindet an RANKL und schützt so den
Knochen vor Abbau Knochenumsatz (remodeling):
Osteoklasten lagern sich mittels Integrinen an das
Glykoprotein Vitronektin der Knochenmatrix an, bilden eine am Rand
abgedichtete Resorptionslakune und sezernieren Protonen und saure
Proteasen, die den mineralischen Knochen bzw. Matrixproteine auflösen.
Osteoblasten füllen die Lakune mit neuer Knochensubstanz auf; sie
bilden Osteoprotegerin, dieses bindet an RANKL und schützt so den
Knochen vor Abbau RANK ist ein Protein in der
Osteoklastenmembran; die Bindung an einen Liganden (RANKL) führt zur
Aktivierung von Osteoklasten. Glucocorticoide hemmen die Bildung von
Osteoprotegerin und stimulieren diejenige von RANKL, und fördern
dadurch den Knochenabbau. Noradrenalin steigert die Exprimierung von
RANKL und fördert Osteoklastenbildung und Knochenresorption
RANK ist ein Protein in der
Osteoklastenmembran; die Bindung an einen Liganden (RANKL) führt zur
Aktivierung von Osteoklasten. Glucocorticoide hemmen die Bildung von
Osteoprotegerin und stimulieren diejenige von RANKL, und fördern
dadurch den Knochenabbau. Noradrenalin steigert die Exprimierung von
RANKL und fördert Osteoklastenbildung und Knochenresorption Mechanische Belastung des Knochens induziert Bewegung extrazellulärer
Flüssigkeit in den Knochenkanälchen, die von Rezeptoren in Zilien von
Kanälchen-Osteozyten registriert wird und zelluläre Signalwege
aktiviert. Vermehrte Scherspannung (z.B. Krafttraining) fördert den
Knochenaufbau, verminderte Reizung (z.B. Immobilisierung) zu
Knochenabbau Mechanische Belastung des Knochens induziert Bewegung extrazellulärer
Flüssigkeit in den Knochenkanälchen, die von Rezeptoren in Zilien von
Kanälchen-Osteozyten registriert wird und zelluläre Signalwege
aktiviert. Vermehrte Scherspannung (z.B. Krafttraining) fördert den
Knochenaufbau, verminderte Reizung (z.B. Immobilisierung) zu
Knochenabbau Der Knochen ist vegetativ innerviert: Osteoblasten, Osteozyten und
Osteoklasten haben α- und
ß-Rezeptoren, deren Aktivierung das Knochenwachstum bremst und den
Abbau fördert; cholinerge Rezeptoren wirken vermutlich anabol
Der Knochen ist vegetativ innerviert: Osteoblasten, Osteozyten und
Osteoklasten haben α- und
ß-Rezeptoren, deren Aktivierung das Knochenwachstum bremst und den
Abbau fördert; cholinerge Rezeptoren wirken vermutlich anabol  >99% des Calciums und 85% des Phosphors im Körper befinden sich in
Knochen und Zähnen. Die empfohlene Ca-Aufnahme ist mindestens 1 g/d
(bei typischer Ernährungsform vorwiegend aus Milch und Milchprodukten).
Der Calciumspeicher kann über die
Knochendichte mit bildgebenden Verfahren (CT, Röntgen-Absorptiometrie)
abgeschätzt werden
>99% des Calciums und 85% des Phosphors im Körper befinden sich in
Knochen und Zähnen. Die empfohlene Ca-Aufnahme ist mindestens 1 g/d
(bei typischer Ernährungsform vorwiegend aus Milch und Milchprodukten).
Der Calciumspeicher kann über die
Knochendichte mit bildgebenden Verfahren (CT, Röntgen-Absorptiometrie)
abgeschätzt werden Die Knochenbelastbarkeit hängt ab vom Grad der körperlichen Aktivität,
vom endokrinen Status (Steroidhormone, Parathormon, D3-Hormon) und der Calciumaufnahme (Ernährung) ab. Diese Faktoren müssen gleichzeitig
optimiert sein, um zu voller Wirkung zu gelangen Die Knochenbelastbarkeit hängt ab vom Grad der körperlichen Aktivität,
vom endokrinen Status (Steroidhormone, Parathormon, D3-Hormon) und der Calciumaufnahme (Ernährung) ab. Diese Faktoren müssen gleichzeitig
optimiert sein, um zu voller Wirkung zu gelangen Bei ungenügender Belastung (lange Bettlägerigkeit, Immobilisierung,
Postmenopause) wird weniger Calcium und Phosphat in den Knochen
eingelagert und mehr mit dem Harn ausgeschieden (Gefahr einer
Urolithiasis) Bei ungenügender Belastung (lange Bettlägerigkeit, Immobilisierung,
Postmenopause) wird weniger Calcium und Phosphat in den Knochen
eingelagert und mehr mit dem Harn ausgeschieden (Gefahr einer
Urolithiasis) |
